
Nach fast zwei (02) Jahrzehnten seit Veröffentlichung des ersten Entwurfs der Leitlinien hat dieUS ArzneimittelbehördeFDA(Food and DrugFDA) im Februar 2022 die Leitlinien zur Populationspharmakokinetik (PK) fertiggestellt. Der neueste Entwurf erläutert die Anwendung der Populations-PK in der Arzneimittelentwicklung und enthält Empfehlungen zur Individualisierung der Therapie. Die Leitlinien gelten für Anträge auf Zulassung neuer Prüfpräparate (Investigational New Drug,IND), Anträge auf Zulassung neuer Arzneimittel (New Drug Applications, NDA), Anträge auf Zulassung biologischer Arzneimittel (Biologics License Applications, BLA) und Anträge auf Zulassung verkürzter neuer Arzneimittel (Abbreviated New Drug Applications, ANDA).
Die Daten aus der Populations-PK-Analyse müssen von den Sponsoren/Arzneimittelherstellern in die Zulassungsanträge aufgenommen werden, um die Tätigkeiten nach der Markteinführung zu vereinfachen. Sie können auch bei der Beantwortung von Zulassungsfragen der Gesundheitsbehörden von entscheidender Bedeutung sein.
Verständnis von Population PK
Die Untersuchung der Variabilität der Arzneimittelkonzentrationen innerhalb einer Patientenpopulation, die klinisch relevante Dosen eines bestimmten Arzneimittels erhält, wird als Populations-PK bezeichnet. Sie zielt darauf ab, die Quellen der Variabilität zu identifizieren und zu quantifizieren, die für die Herstellung und Dosierungsempfehlungen für die genannten Arzneimittel nützlich sind.
Zum Verständnis des gesamten Prozesses der Bevölkerungs-PK kann die folgende Abbildung herangezogen werden:
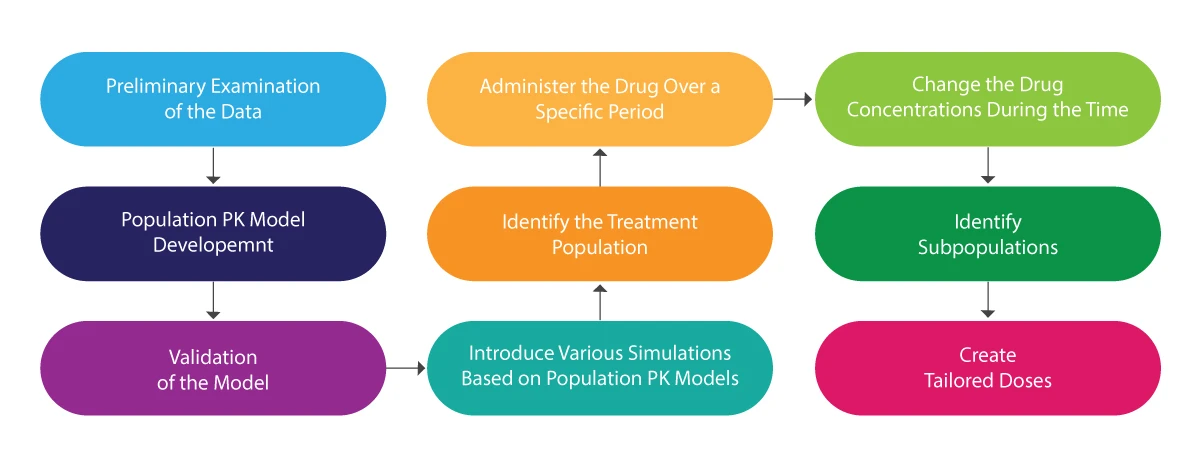
Populations-PK-Analyse - wie kann sie helfen?
- Hilft bei der Erstellung von maßgeschneiderten Dosierungsschemata.
- Liefert eine zuverlässige Schätzung der Kovariate (eine Variable, deren Veränderung in einer Untersuchung/Studie vorhergesagt werden kann und die zur Vorhersage des Ergebnisses der besagten Studie verwendet werden kann).
- Berücksichtigt Faktoren wie Demografie, Umweltbedingungen, biologische Faktoren, Begleitmedikamente (andere Medikamente, die die Patienten während der Studie einnehmen) und die Arzneimittelkonzentration.
- Nützlich für die Planung sicherer und qualitativer klinischer Studien, auch in der Pädiatrie.
- Beschaffen Sie sich eine Expositionsmatrix für die Durchführung einer Expositions-Wirkungs-Analyse.
Ein Überblick über die endgültigen LeitlinienFDA US FDAzur Populationspharmakokinetik
Der endgültige Entwurf gibt einen Einblick in die derzeitige Haltung FDAzu den Daten aus der populationspharmakokinetischen Analyse und den Modellvorlagen, die bei regulatorischen Entscheidungen herangezogen werden. Hier ein kurzer Überblick über den Entwurf:
Kennzeichnung - Sie enthält Empfehlungen zur Aufnahme der geeigneten Informationen aus der genannten Analyse in die Kennzeichnung. Die Ergebnisse sind im Abschnitt "Klinische Pharmakologie" darzustellen und in anderen Abschnitten der Etikettierung je nach Bedarf zusammenzufassen.
Inhalt – Der Inhalt und das relevante Format, das bei der Einreichung von Populations-PK-Berichten bei der FDA zu beachten ist, FDA ebenfalls detailliert beschrieben.
Regulatorische Entscheidungen - Die PK-Berichte für die Bevölkerung, die für regulatorische Entscheidungen nützlich sind, müssen in Modul 5 des gemeinsamen elektronischen technischen Dokuments (eCTD) aufgenommen werden.
Vorwärts gehen
Sponsoren, die Beratung zur Verwendung der Populations-PK-Analyse in ihrem Arzneimittelentwicklungsprozess oder zur Beantwortung regulatorischer Fragen benötigen, wurden gebeten, dies bei ihren wichtigen Besprechungen mit der Behörde zu tun. Darüber hinaus ist es unerlässlich, dass eine gute Modellleistung für genaue Ergebnisse gewährleistet ist. Dies kann durch die Verwendung ausreichender PK-Daten zur spezifischen Patientenpopulation und zu relevanten Subpopulationen erreicht werden.
Für Arzneimittelhersteller/-sponsoren kann es eine Herausforderung sein, genaue Populations-PK-Berichte im eCTD-Format einzureichen und die Kennzeichnungsvorschriften einzuhalten. Reach an einen Regulierungsexperten wie Freyr, der Sie bei Ihren Einreichungen und regulatorischen Kennzeichnungsaktivitäten unterstützen kann .









