
Wenn ein ausländisches Unternehmen an der Herstellung eines Medizinprodukts beteiligt ist, das in die Vereinigten Staaten (US) importiert wird, muss für dieses Unternehmen ein US benannt werden. Der US fungiert als Ansprechpartner für alle Mitteilungen US and Drug Administration (US FDA) in Bezug auf die im Ausland registrierte Einrichtung. Da diese Kommunikation zeitkritisch sein kann, ist es unerlässlich, dass der US über umfassende Kenntnisse der FDA verfügt und in der Lage ist, das ausländische Unternehmen hinsichtlich der Einhaltung der AnforderungenFDAan Medizinprodukte zu beraten. Darüber hinaus hilft ein unabhängiger US dabei, potenzielle Interessenkonflikte zu vermeiden, die entstehen können, wenn ein Geschäftspartner als US benannt wird. In diesem Blog werden wir uns eingehend mit den Details der Registrierung eines ausländischen Unternehmens bei derFDA befassen.
Was ist eine Betriebsstättenregistrierung?
Die jährliche Registrierung bei der US FDA für Auftragshersteller, Erstimporteure, Umverpacker/Umetikettierer, Spezifikationsentwickler usw. von Einrichtungen vorgeschrieben, die sich mit der Herstellung und dem Vertrieb von Medizinprodukten für den US-Markt befassen. Dieses Verfahren wird als „Establishment Registration” (Titel 21 CFR Teil 807) bezeichnet.
Who muss eine Betriebseintragung beantragen?
Betreiber von Einrichtungen, die medizinische Geräte für den Gebrauch in den US herstellen und vertreiben, US sich jährlich bei der US FDA registrieren lassen. Folgende Arten von Betreibern können eine Registrierung ihrer Einrichtung beantragen:
- Eigentümer häuslicher Einrichtungen
- Inhaber ausländischer Niederlassungen
- Vertragshersteller
- Erstimporteure
- Umverpacker/Etikettierer
- Spezifikationsentwickler
Welche Schritte umfasst das Verfahren zur Registrierung einer Niederlassung?
Um ein Medizinprodukteunternehmen bei der US FDA zu registrieren, müssen Sie die im folgenden Flussdiagramm dargestellten Schritte befolgen.
Abbildung 1: Schritte des Verfahrens zur Eintragung einer Niederlassung
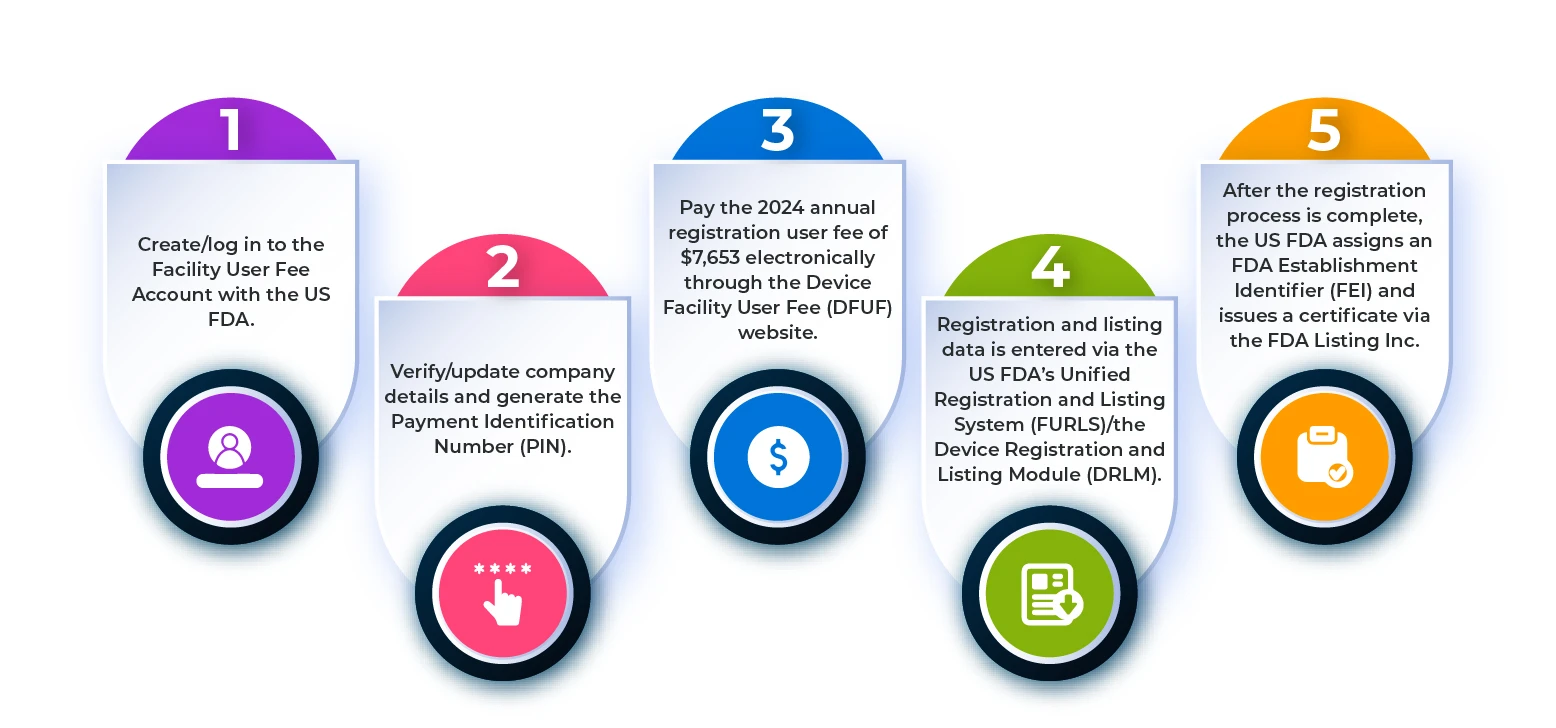
Was sind die Anforderungen für die Registrierung und Auflistung ausländischer Niederlassungen?
Das Verständnis der Bedeutung der Wahl eines unabhängigen, fachkundigen US hilft ausländischen Unternehmen dabei, der Vermeidung von Interessenkonflikten Priorität einzuräumen, was für sie bei der Bewältigung der komplexen Anforderungen der US FDA von größter Bedeutung ist. Ausländische Unternehmen müssen ihr Verständnis für die Voraussetzungen zur Erreichung der Compliance stärken, enge Partnerschaften mit US pflegen und die Voraussetzungen für einen reibungslosen Registrierungsprozess schaffen. Die folgende Tabelle gibt einen Überblick über die Registrierungs- und Listungsanforderungen basierend auf den Aktivitäten eines ausländischen Unternehmens. Sie gibt auch an, für welche Aktivitäten eine Registrierungsgebühr anfällt.
Tabelle 1: Anforderungen an die Registrierung und Börsennotierung auf der Grundlage der Aktivitäten einer ausländischen Niederlassung
| Tätigkeit | Register | Liste | Gebühr bezahlen | |
| Lohnhersteller (einschließlich Lohnverpacker) | JA 807.40 (a) | JA 807.40 (a) | YES | |
| Vertrags-Sterilisator | JA 807.40 (a) | JA 807.40 (a) | YES | |
| Kundenspezifische Gerätehersteller | JA 807.20 (a) (2) | JA 807.20 (a) (2) | YES | |
| Gerät, das im Rahmen einer IDE (Investigational Device Exemption) untersucht wird | NO 812.1 (a) | NO 812.1(a),807.40 (c) | NO | |
| Ausländische Exporteure von Geräten mit Sitz im Ausland | JA 807.40 (a) | JA 807.40 (a) | YES | |
| Ausländische Hersteller (einschließlich Kit-Assemblierer) | JA 807.40 (a) | JA 807.40 (a) | YES | |
| Führt Beschwerdeakten wie in 21 CFR 820.198 vorgeschrieben | YES | YES | YES | |
| Hersteller von Zubehör, das für den kommerziellen Vertrieb zu gesundheitsbezogenen Zwecken an einen Endverbraucher verpackt oder etikettiert ist | JA 807.20 (a) (5) | JA 807.20 (a) (5) | YES | |
| Hersteller von Komponenten, die nur an einen Endgerätehersteller vertrieben werden | NO 807.65 (a) | NO | NO | |
| Umetikettierer oder Umverpacker | JA 807.20 (a) (3) | JA 807.20 (a) (3) | YES | |
| Wiederaufbereiter | YES | YES | YES | |
| Aufbereitungsgerät für Einwegprodukte | JA 807.20 (a) | JA 807.20 (a) | YES | |
| Spezifikationsentwickler | YES | YES | YES | |
Die Registrierung bei der US FDA eine wesentliche Voraussetzung für ausländische Unternehmen, die in den US Medizinprodukte herstellen, verkaufen, umverpacken oder importieren. Diese Registrierung gewährleistet die Einhaltung der strengen Vorschriften und StandardsFDA US FDA. Freyr bietet wertvolle Unterstützung für Unternehmen, die während des Registrierungsprozesses fachkundige Beratung benötigen. Mit seinem Fachwissen und seiner Kenntnis der VorschriftenFDA US FDAhilft Freyr ausländischen Unternehmen bei der Erfüllung der Compliance-Anforderungen, was letztlich zu einem reibungsloseren und effizienteren Eintritt in den US Markt US führt. Wenn Sie mehr über den Registrierungsprozess bei der US FDA erfahren möchten, reach noch heute an uns. Bleiben Sie informiert! Bleiben Sie compliant!









