
Software für medizinische Geräte wird in Südkorea zur Diagnose, Behandlung und Überwachung von Patienten im modernen Gesundheitssystem eingesetzt. Sie umfasst sowohl eingebettete Software, die in medizinische Geräte integriert ist, als auch eigenständige Software, die auf PCs, mobilen Geräten und webbasierten Diensten genutzt werden kann. Das südkoreanische Ministerium für Lebensmittel- und Arzneimittelsicherheit (Ministry of Food and Drug Safety, MFDS) ist für die Regulierung von Software für medizinische Geräte und die Gewährleistung ihrer Sicherheit und Wirksamkeit zuständig. Am 05. Juli 2023 legte das MFDS Kriterien für die Zulassung und Überprüfung von Software für Medizinprodukte fest; diese Vorschriften bieten eine Struktur, an die sich zivile Antragsteller halten können, wenn sie Software zur Zulassung oder Überprüfung einreichen.
Die Vorschriften behandeln eine Vielzahl von Themen, darunter den Anwendungsbereich, Anforderungen an die technische Dokumentation und Berichte zur Überprüfung der Konformität. Zusätzlich zu den MFDS-Richtlinien gibt es internationale Normen und Leitlinien, die für Medizinproduktesoftware gelten, wie beispielsweise die Norm 62304 der Internationalen Elektrotechnischen Kommission (IEC) für Software-Lebenszyklusprozesse und die Leitlinien der US-amerikanischen Food and Drug Administration (US FDA) zu mobilen medizinischen Anwendungen.
Softwareentwicklungsplan und Anforderungsanalyse
- Der Softwareentwicklungsplan umreißt den Gesamtansatz für die Softwareentwicklung, einschließlich Spezifikationen, Methoden und Entwicklungswerkzeuge. Er umfasst auch die Überprüfung, das Risikomanagement für Medizinprodukte, das Konfigurationsmanagement und die Dokumentation.
- Die Anforderungsanalyse legt die Anforderungen an die Software von Medizinprodukten fest, einschließlich der Maßnahmen zur Risikokontrolle und der Verifizierungsmethoden. Durch sorgfältige Planung und Analyse des Softwareentwicklungsprozesses können die Entwickler sicherstellen, dass die resultierende Software die erforderlichen Sicherheits- und Wirksamkeitsstandards erfüllt.
- Der Software-Konformitätsprüfungsbericht enthält einen Überblick über den Software-Entwicklungsplan, die Dokumentenkontrollnummer des Herstellers und eine Übersicht über die Anforderungsanalyse. Durch die Einhaltung dieser Richtlinien kann die Entwicklung von Software für medizinische Geräte in dem Wissen erfolgen, dass sie strengen Tests unterzogen wurde und die erforderlichen Standards für Sicherheit und Wirksamkeit erfüllt.
Verifizierung und Validierung von Software für medizinische Geräte
- Die Verifizierung von Software für medizinische Geräte stellt sicher, dass die Software die festgelegten Anforderungen erfüllt.
- Die Validierung von Software für medizinische Geräte stellt sicher, dass die Software den Anforderungen des Anwenders und der beabsichtigten Verwendung(en) entspricht.
- Der Verifizierungs- und Validierungsbericht für Software für medizinische Geräte beschreibt den Verifizierungs- und Validierungsprozess und enthält den Produktnamen, die Revision und die Namen der Personen who den Bericht geprüft und genehmigt haben. Der Bericht kann je nach den Merkmalen der Software variieren, sollte aber eine Beschreibung der Software, der verwendeten Verifizierungs- und Validierungsmethoden sowie der Testergebnisse enthalten.
Betriebsumgebung und Software unbekannter Herkunft (SOUP)
- Wenn die Software von spezifischer Hardware abhängig ist, wie z. B. bei eingebetteter Software, sollte das technische Dokument die Hardwarespezifikationen beschreiben.
- Handelt es sich jedoch um eine eigenständige Software, die für den Einsatz auf allgemeiner Hardware entwickelt wurde, muss die Betriebsumgebung im Rohmaterial beschrieben werden. Dazu gehören die empfohlenen Mindestspezifikationen, wie Microsoft Windows 10 oder höher.
- Wenn die Medizinproduktesoftware kommerzielle Software unbekannter Herkunft (SOUP) enthält, muss außerdem eine Betriebsumgebung geschaffen werden, um das ordnungsgemäße Funktionieren sicherzustellen. Durch eine sorgfältige Beschreibung der Betriebsumgebung und die Berücksichtigung von SOUP können Entwickler sicherstellen, dass ihre Medizinproduktesoftware für den vorgesehenen Einsatz sicher und effektiv ist.
Risikomanagement und Dokumentationsanforderungen für Medizinprodukte
- Der Risikomanagementprozess für software as a medical device umfasst die Identifizierung von Gefahrensituationen, die Festlegung von Risikokontrollmaßnahmen, die Überprüfung dieser Maßnahmen und die Verwaltung von Softwareänderungen.
- Das MFDS-RM-Dokument zum Software-Risikomanagement enthält Informationen zum Software-Risikomanagement.
- Darüber hinaus sind Dokumentationsanforderungen unerlässlich, um sicherzustellen, dass die Software die erforderlichen Sicherheits- und Wirksamkeitsstandards erfüllt.
- Der Softwareentwicklungsplan, die Analyse der Softwareanforderungen für Medizinprodukte und die Berichte über die Verifizierung und Validierung der Software müssen in die Dokumentation aufgenommen werden.
- Der Software-Konformitätsprüfungsbericht beschreibt die Dokumentationsanforderungen; er enthält auch eine Übersicht über die anwendbaren Dokumente und die Dokumentenkontrollnummer des Herstellers.
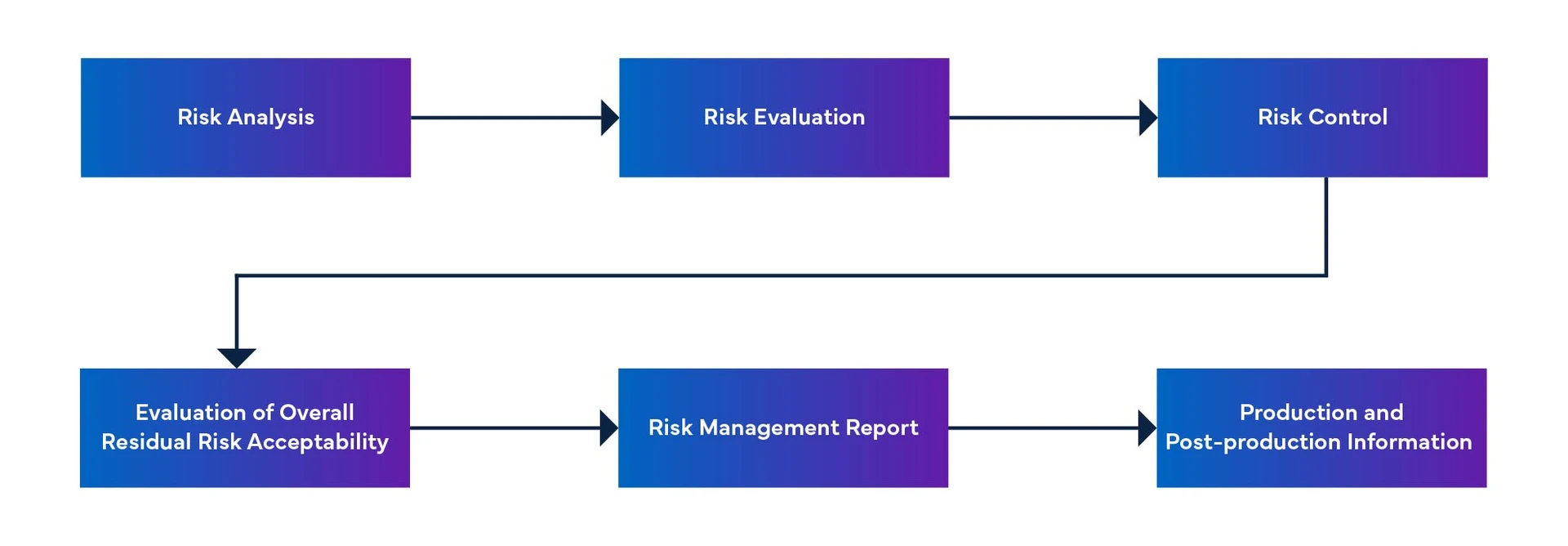
Abbildung 1: Risikomanagementprozess für Medizinprodukte
Ungelöste Anomalien und Abhilfemaßnahmen für SaMD
- Das Dokument MFDS-PR (Software Problem Resolution) umreißt den Prozess zur Lösung von Softwareproblemen, der die Meldung von Problemen, die Analyse, die Implementierung und die Überprüfung umfasst.
- Das Dokument enthält auch eine Liste von ungelösten Problemen, Fehlern, Mängeln und Anomalien sowie eine Bewertung des Restrisikos für das Softwaresystem.
- Die zur Behebung dieser Probleme ergriffenen Abhilfemaßnahmen müssen im Softwarewartungsplan dokumentiert werden, der gemäß dem Softwarewartungsprozess erstellt wird.
- Das MFDS-Wartungsdokument enthält Informationen über SaMD Software-Wartung und Fehlersuche.
Anforderungen an die Prüfung und Einreichung technischer Dokumente für SaMD
Die wichtigsten Dokumente während des Überprüfungsprozesses sind die Leistungsdaten, der Konformitätsbestätigungsbericht und die Verifizierungs- und Validierungsdaten der Medizinproduktesoftware, die Software-Design-Spezifikation (SDS), das Software Requirements Statement (SRS) des Medizinproduktes sowie die Verifizierungs- und Validierungsberichte. Der Konformitätsbestätigungsbericht und der Verifizierungs- und Validierungsbericht für Medizinproduktesoftware müssen eingereicht werden.
Risikomanagement von Software für medizinische Geräte
- Identifizierung potenzieller Gefahren im Zusammenhang mit der Software und ihrer Verwendung.
- Bewertung der Schwere der mit diesen Gefahren verbundenen Risiken.
- Durchführung von Maßnahmen zur Risikokontrolle, um die Wahrscheinlichkeit eines Schadens zu minimieren.
- Überwachung und Überprüfung der Wirksamkeit dieser Risikokontrollmaßnahmen.
- Dokumentation aller Aktivitäten und Entscheidungen des Risikomanagements für Medizinprodukte.
In einem Softwaresystem werden Softwareelemente in kleinere Teile zerlegt, einschließlich detaillierter Softwareelemente. Wenn ein Element nicht weiter aufgeschlüsselt werden kann, wird es als Einheit bezeichnet. Das System ermöglicht eine Untergliederung bis zur Einheitsebene und hilft bei der Bestimmung der Sicherheitsstufe für jedes Softwareelement. Wenn wir diese Softwareelemente zusammensetzen, können wir die Sicherheitsstufe für das gesamte Softwaresystem ermitteln.
Abbildung 2: Demontage und Integration von Software für medizinische Geräte
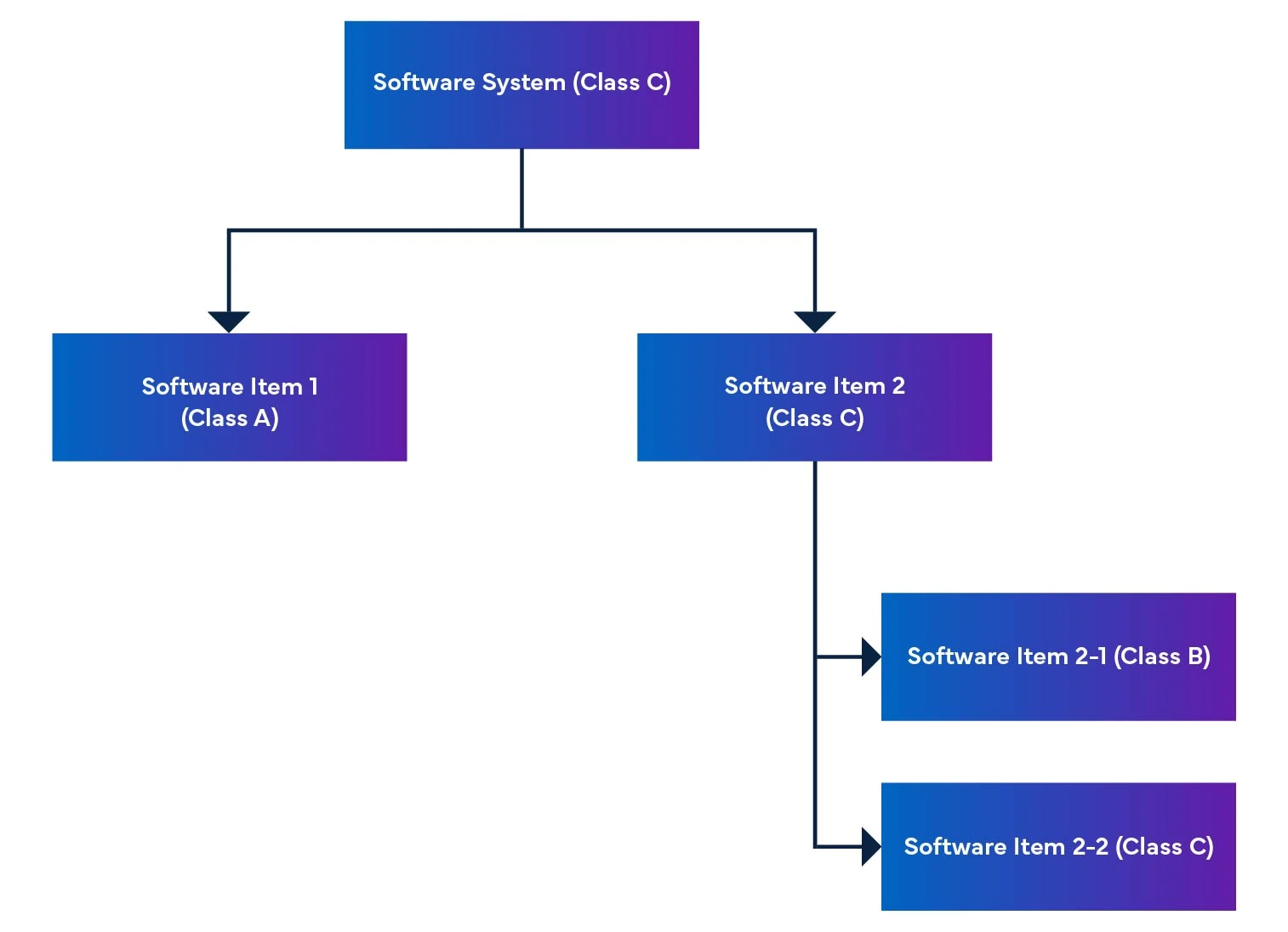
In der Verordnung wird auch die Software-Sicherheitsbewertung erwähnt, eine Bewertung zur Identifizierung der Risiken von SaMD (siehe Tabelle 1).
Tabelle 1: Definition der Sicherheitsbewertung
| Bewertung | Definition der Software-Sicherheitsklasse für medizinische Geräte |
| Klasse A | Keine Möglichkeit einer Verletzung oder eines körperlichen Schadens. |
| Klasse B | Weniger schwere Verletzungen (leichte Verletzungen) sind wahrscheinlich. |
| Klasse C | Möglichkeit von schweren Verletzungen oder Tod. |
Software-Konfigurationsmanagement
- Führen einer genauen und aktuellen Dokumentation für alle Softwareversionen, Änderungen und Aktualisierungen.
- Sicherstellung, dass alle Unterlagen ordnungsgemäß geprüft und genehmigt werden.
- Einführung von Verfahren zur Verwaltung von Softwarekonfigurationsänderungen.
- Dokumentation aller Aktivitäten und Entscheidungen des Softwarekonfigurationsmanagements.
Software-Wartung
- Regelmäßiges Testen und Überwachen der Software, um sicherzustellen, dass sie für die vorgesehene Verwendung sicher und wirksam bleibt.
- Implementierung von Verfahren zur Behebung etwaiger Probleme, einschließlich Fehlerbehebungen und Software-Updates.
- Dokumentation aller Softwarewartungsaktivitäten und -entscheidungen.
Fehlersuche
- Identifizierung der Grundursache des Problems.
- Durchführung von Abhilfemaßnahmen zur Beseitigung des Problems.
- Dokumentation des gesamten Fehlerbehebungsprozesses zur späteren Verwendung.
Durch die Befolgung der oben genannten Richtlinien können Entwickler sicherstellen, dass alle Probleme mit ihrer Medizinproduktsoftware ordnungsgemäß behandelt und dokumentiert werden und dass die Software die erforderlichen Anforderungen für die Zulassung oder Prüfung erfüllt.
Wenn Sie ein Hersteller von Medizinprodukten sind, der die südkoreanischen Softwarestandards für Medizinprodukte einhalten möchte, können die Regulierungsexperten von FreyrSie durch die komplizierte Regulierungslandschaft des Landes führen. Wir stellen sicher, dass Ihre Geräte den neuesten südkoreanischen Vorschriften für Medizinprodukte entsprechen, um eine nahtlose Konformität zu gewährleisten. Kontaktieren Sie us und erfahren Sie mehr!









