24. September 2016; nur noch einen Monat bis zum Stichtag für die Einhaltung der UDI-Vorschriften (Unique Device Identifier) für Klasse-II-Geräte. Wir gehen davon aus, wenn auch nicht sicher, dass alle Hersteller von Medizinprodukten mit einem umfassenden Regulierungsplan gut ausgestattet sind. Abgesehen davon, dass sie die Governance-Voraussetzungen fest im Griff haben, wird von den Herstellern erwartet, dass sie für die Einhaltung der Vorschriften auditbereit sind. Von der Validierung von Device Identifier (DI)- und Product Identifier (PI)-Datensätzen bis hin zu erfolgreichen GUDID-Einreichungen sollten sie über die einzureichenden Daten und die zu befolgenden Verfahren Bescheid wissen. Sowohl vor der Einreichung als auch nach der Einreichung können bessere Kenntnisse über die Verfahren die Hersteller vor den entsprechenden Herausforderungen in Bezug auf die Datenaggregation, die Einreichung von DI-Datensätzen und die Verwaltung von Gerätemeldungen, die Verfolgung von HA-Bestätigungen usw. schützen.
Um Herstellern in solchen Szenarien eine bessere Ausgangsposition zu verschaffen, stellen wir hier eine schnell verständliche Infografik zu den Herausforderungen der UDI-Compliance im Vergleich zu den Lösungen zur Verfügung, die Ihnen Zeit sparen könnte, um die Komplexität der Compliance zu entschlüsseln und die Roadmap besser zu planen und zu strukturieren
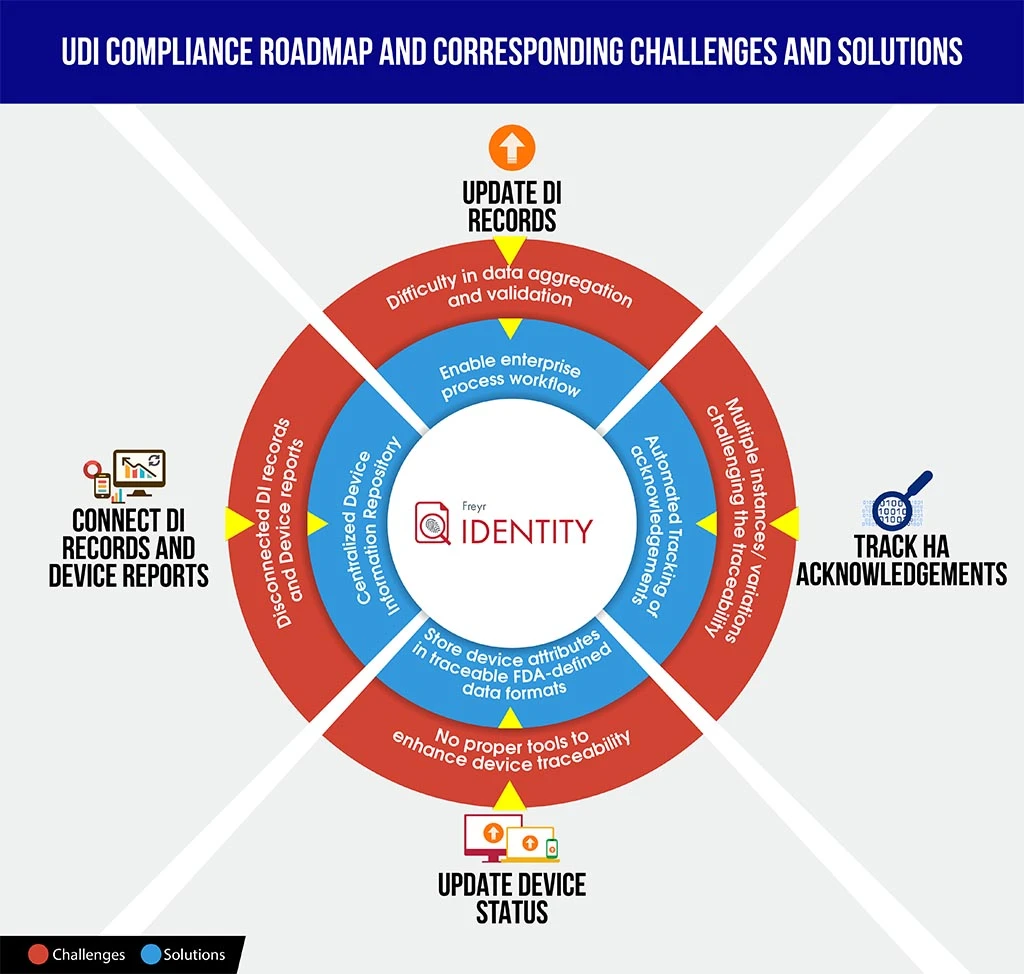
Um Ihr Unternehmen reibungslos durch diesen komplexen Compliance-Prozess zu führen, Freyr das Beste aus beiden Welten – die bedarfsgerechte, vollständig konfigurierbare UDI-SoftwarelösungFreyr sowie ein UDI Centre of Excellence (CoE), das erstklassige, kostengünstige und anpassbare UDI-Dienstleistungen anbietet, die auf Ihre individuellen und anspruchsvollen Anforderungen zugeschnitten sind.









