Die Medizinprodukteverordnung der Europäischen UnionEU MDR) 2017/745 definiert den Bereich der sterilen Medizinprodukte als Produkte, die frei von Mikroorganismen (Bakterien, Viren usw.) sein müssen. Produkte der Klasse I mit steriler Funktion können ebenfalls eine Selbstzertifizierung erhalten, die sich jedoch in Bezug auf die Anforderungen von anderen Unterkategorien von Produkten der Klasse I unterscheidet.
Die Anforderungen an Produkte der Klasse I sind von der Herstellung bis zum Inverkehrbringen des Produkts sehr unterschiedlich. Das Gleiche gilt für Medizinprodukte der Klasse I mit sterilen Bedingungen. Handelt es sich beispielsweise um ein Produkt der Klasse I mit steriler Funktion, so unterscheiden sich die Anforderungen an die Herstellung und die Einrichtung eines Quality Management System (QMS) erheblich von denen für Produkte der Klasse I mit Messfunktionen.
Dieser Artikel enthält eine kurze Checkliste, die beim Inverkehrbringen eines Produkts der Klasse I unter sterilen Bedingungen in der Europäischen Union zu beachten ist. Die Checkliste soll die Hersteller dabei unterstützen, fundierte Entscheidungen zu verschiedenen Aspekten zu treffen.
Dos!
Vor der Herstellung den Umfang kennen
Gemäß der EU MDR müssen Medizinprodukte mit sterilen Funktionen mit geeigneten Verfahren entwickelt und hergestellt werden, um die Sterilität bis zum Inverkehrbringen zu gewährleisten. Die Produkte können nur nach geeigneten Reinigungs-, Desinfektions- und Sterilisationsverfahren wiederverwendet werden.
Die Wahl der richtigen Sterilisationsverfahren
Es gibt verschiedene Sterilisationsmethoden, die ein Hersteller für die Sterilisation des Geräts wählen kann. Die Ethylenoxid (EtO)-Methode wird häufig für die Sterilisation von Medizinprodukten verwendet. Die Wahl der Sterilisationsmethode muss angemessen begründet werden. Einige Normen, die Hersteller für die Einrichtung, Sicherung und Aufrechterhaltung der Sterilisation befolgen können, sind EN ISO 14937, ISO TS 21387, ISO TS 13004, ISO 11137 und andere.
Beachten Sie auch, dass die Dokumentation der detaillierten Sterilisationsmethode, der prozessbegleitenden Methode und der Datenvalidierung genau erfolgen muss. Informationen zur Sterilisation, wie z. B. Erhitzungstemperatur, Raumbedingungen, Prozessvalidierungen usw., müssen gemäß den EU MDR bereitgestellt werden.
Kenntnis der Anforderungen und der zu befolgenden Leitlinien
Einer der wichtigsten Schritte besteht darin, die technischen Anforderungen zu dokumentieren und die im Rahmen der EU MDR akzeptierten Normen zu kennen. So ist beispielsweise EN 556 die europäische Norm für sterilisierte Produkte. In der EN 556 sind die Anforderungen für die Einstufung eines Medizinprodukts als steril beschrieben. Darüber hinaus legt die ISO TS 19930 Strategien zur Sicherstellung der Sterilität von Produkten fest. Sie ist jedoch noch nicht als EU-Norm angenommen.
Kennen Sie Ihre Route
Bei der Erlangung der CE-Kennzeichnung sollten Sie sich über die Beteiligung der benannten Stellen und den Weg der Konformitätsbewertung informieren. Außerdem müssen Medizinprodukte unter sterilen Bedingungen die Anhänge IX und XI erfüllen.
Die Beteiligung einer benannten Stelle ist erforderlich, aber begrenzt. Bei sterilen Produkten wird die Beteiligung der benannten Stellen in Bezug auf die Aufrechterhaltung und Sicherung der Sterilitätsbedingungen erfolgen. Die Konformitätsbewertungen umfassen zum Beispiel mikrobiologische Bewertungen, aseptische Verfahren usw.
Verbote!
Verpassen Sie nicht die Verpackungs- und Kennzeichnungsvorschriften

Bei sterilen Produkten gibt es zusätzliche Anforderungen an die Verpackung und Kennzeichnung. Bei der Einhaltung der Verpackungs- und Kennzeichnungsvorschriften sollte man nicht die Informationen vergessen, die angebracht werden müssen. Der erste und wichtigste Schritt ist die Anbringung eines Sterilitätssymbols (siehe unten) auf der Produktkennzeichnung.
Informationen wie die Erklärung des sterilen Zustands, die Sterilisationsmethode, Anweisungen für den Fall, dass die Sterilverpackung beschädigt oder unbeabsichtigt geöffnet wird, usw. müssen enthalten sein. Auch die Haltbarkeitsdauer des sterilen Produkts und das Verfahren zur erneuten Sterilisation (falls zutreffend) müssen angegeben werden. Die Kennnummer einer benannten Stelle sollte ebenfalls auf dem Produkt angebracht sein.
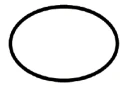
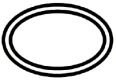
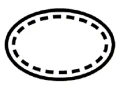
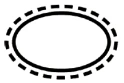
Einige der Symbole, die (je nach Anwendbarkeit) auf der Kennzeichnung von sterilen Medizinprodukten angebracht werden müssen, sind:
Symbol | Anzeige |
| Sterile Medizinprodukte mit Sterilisationsverfahren als aseptische Technik |
| Sterile medizinische Geräte mit einer Sterilisationsmethode, die Ethylenoxid verwendet |
| Sterile medizinische Geräte mit Sterilisationsverfahren wie trockene Hitze oder Dampf |
| Sterile medizinische Geräte mit Sterilisationsmethode durch verdampftes Wasserstoffperoxyd |
| Sterile medizinische Geräte mit Sterilisationsverfahren durch Bestrahlung |
| Das Gerät kann nicht erneut sterilisiert werden |
| Das Gerät ist nicht sterilisiert |
| Verwenden Sie es nicht, wenn die Verpackung beschädigt ist. |
| Einfaches Sterilbarrieresystem |
| Doppeltes Sterilbarrieresystem |
| Einfaches Sterilbarrieresystem mit Schutzverpackung im Inneren |
| Einfaches Sterilbarrieresystem mit Schutzverpackung außen |
Vergessen Sie nicht die Anforderungen für die Platzierung nach dem Inverkehrbringen
Die Sterilprodukte sind verpflichtet, Aufzeichnungen über unerwünschte Ereignisse zu führen, falls diese auftreten. In diesem Fall müssen die aufgezeichneten Vorkommnisse, z. B. in Form von Dokumenten, den zuständigen Behörden auf Verlangen vorgelegt werden.
Die EU MDR enthält spezifische Anforderungen für die Selbstzertifizierung. Es handelt sich um ein komplexes Verfahren, wobei der Hauptfaktor die verschiedenen Klassen innerhalb der Klasse I und ihre unterschiedlichen Aspekte der Anforderungen für die Erlangung einer CE-Kennzeichnung sind. Hersteller von Produkten der Klasse I, die unter sterilen Bedingungen hergestellt werden, sollten sich des Anwendungsbereichs und der spezifischen Anforderungen bewusst sein.
Möchten Sie die verschiedenen Aspekte von Sterilgut der Klasse I im Detail verstehen? Möchten Sie dies mit einem ausgewiesenen Experten besprechen? Reach Sie us an.