
Das Risikomanagement ist in allen Phasen des Lebenszyklus von Medizinprodukten von entscheidender Bedeutung, da es sich direkt auf die Sicherheit und das Wohlbefinden der Patienten auswirkt. Risiken sind unvermeidlich; sie können jedoch eingedämmt werden, wenn sich die Unternehmen der drohenden Gefahren bewusst sind und wirksame Risikomanagementverfahren anwenden.
Die Fehler-Möglichkeits- und Einfluss-Analyse (FMEA) ist ein Überprüfungsinstrument zur Ermittlung möglicher Fehler in einer Konstruktion, einem Herstellungs- oder Montageprozess oder einem Produkt oder einer Dienstleistung in einem Gerät. "Fehlermodi" bezieht sich auf die Art und Weise, wie ein Gerät versagen kann, was möglicherweise Auswirkungen auf die Patienten hat. Die "Wirkungsanalyse" bezieht sich auf die Untersuchung der Folgen dieser Ausfälle. Sie ist ein schrittweiser Ansatz zur Gewährleistung der Zuverlässigkeit und Qualität eines Produkts.
Es gibt zwei Arten von FMEAs: Konstruktions-FMEA (DFMEA) und Prozess-FMEA (PFMEA). Im Zusammenhang mit medizinischen Geräten verwenden Gerätehersteller die DFMEA zur Bewertung von Fehlern in Bezug auf das Gerätedesign und die Spezifikationen, während die PFMEA zur Verbesserung des Herstellungsprozesses eingesetzt wird.
Obwohl die FMEA den Aspekt des Risikos einbezieht, ist sie kein Risikomanagementsystem. Die Anforderungen an das Risikomanagement sind in der ISO 14971:2019 definiert, die den Herstellern von Medizinprodukten als Rahmen für die Vorhersage der Wahrscheinlichkeit von Risiken und deren Folgen während des gesamten Produktlebenszyklus dient. Die FMEA-Methodik der Risikobewertung ist nicht mit der ISO 14971:2019 abgestimmt. Für die FMEA gibt es eine eigene international anerkannte Norm, die IEC 60812:2018, in der erläutert wird, wie die Fehlermöglichkeits- und Einflussanalyse geplant, durchgeführt, dokumentiert und gepflegt wird. Die FMEA und die ISO 14971 unterscheiden sich in bestimmten Aspekten voneinander, die im Folgenden aufgeführt sind:
Normaler Gebrauch und Störungszustand
Gemäß ISO 14971 umfasst das Risikomanagement sowohl die normale als auch die fehlerhafte Verwendung des Produkts, während die FMEA nur die Risiken im Zusammenhang mit dem Ausfall des Produkts berücksichtigt. Ein einfaches Beispiel hierfür wären die Risiken im Zusammenhang mit einer intravenösen (IV) Leitung. Die ISO 14971 berücksichtigt das potenzielle Risiko einer Infektion trotz korrekter Verabreichung einer Infusion. Dies kann verschiedene Gründe haben, wie z. B. eine geringe Immunität des Patienten und Infektionen im Krankenhaus/im klinischen Umfeld. Diese Risiken werden bei einer FMEA-Bewertung nicht berücksichtigt. Obwohl die Hersteller von Medizinprodukten diese Risiken nicht vollständig vermeiden können, können sie die Anwender auf die mit der Verwendung des Produkts verbundenen Restrisiken aufmerksam machen.
Bewertung des Schweregrads
Die ISO 14971 betrachtet die Schwere des Risikos auf der Grundlage der Gefährdung von Menschenleben, während die FMEA dasselbe auf der Grundlage von Störungen der Systemleistung betrachtet. Der Schweregrad des Risikos kann in der FMEA als niedrig eingestuft werden, wenn es zu einem geringfügigen Funktionsverlust kommt, auch wenn dieser zum Verlust von Menschenleben führen kann. Der Schweregrad wird als hoch eingestuft, wenn das Gerät ausfällt.
Beispielsweise FDA einen Führungsdraht (Klasse I) FDA , der in einen perkutanen Katheter eingeführt wird, um diesen durch ein Blutgefäß zu führen. Bei dem betreffenden Führungsdraht besteht die Gefahr, dass sich die Beschichtung ablöst. Die FMEA stufte dies nach der Bewertung möglicherweise als geringes Risiko ein, jedoch kann dies schwerwiegende Auswirkungen auf die Gesundheit des Patienten haben.
Das Verfahren zur Bewertung von Risiken/Fehlermodi
FMEA und ISO 14971 unterscheiden sich in der Art und Weise, wie das Risiko bewertet wird. Bei der FMEA wird das Risiko durch die Identifizierung potenzieller Fehlerarten und -auswirkungen bewertet, gefolgt von einer Einstufung des Schweregrads von Fehlern. Jede der potenziellen Ursachen wird identifiziert und die Wahrscheinlichkeit ihres Auftretens wird bestimmt. Das Risiko wird auf der Grundlage der Risikoprioritätszahl (RPZ) bewertet.
FMEA-Abbildung
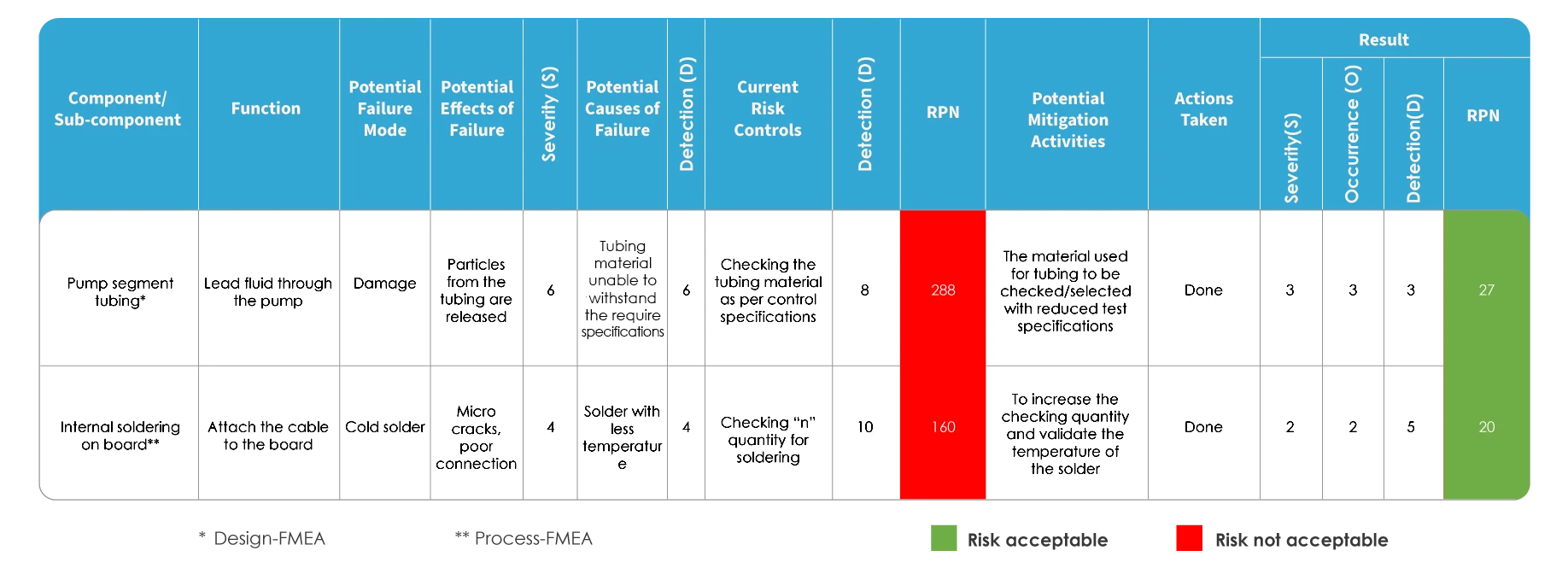
Bei der Abbildung des Risikomanagements nach ISO 14971 wird ein Rückverfolgbarkeitstool verwendet, das als Hazard Traceability Matrix (HTM) bekannt ist. Sie umfasst die Risikoanalyse, die Bewertung, die Kontrolle und die Bewertung des Restrisikos.
Matrix für die Rückverfolgbarkeit von Gefahren
| Risikoanalyse | Risiko Eval. | Risikokontrolle | ||||||||||||
| ID | Gefährdung | Vernünftigerweise vorhersehbare Abfolge oder Kombination von Ereignissen | Gefährlich Situation | Schaden | Vorkommen | Schweregrad | Annehmbar? | Optionen zur Risikokontrolle und Gründe dafür | Risikokontrolle Maßnahmen | Risiko Kontrolle Überprüfung | Status | Risikopotenzial | Schwere des Risikos | Verbleibendes Risiko |
| 1 | Netzspannung | Der Benutzer benutzt das Gerät | Der Benutzer/Patient kann während des Kontakts mit dem Gerät Netzspannung ausgesetzt sein | Tod des Benutzers/Patienten | 5 | 5 | N | Sicherheit durch eine Änderung des Designs und Schutzmaßnahmen können an Ort und Stelle positioniert werden. | Ausführung gemäß IEC 61010. | Die elektrischen Prüfungen müssen gemäß IEC 61010 durchgeführt werden. | Erledigt | 2 | 2 | Y |
![]()
Nach Erörterung der Unterschiede zwischen den beiden Normen kann man zu dem Schluss kommen, dass die ISO 14971 einen umfassenden Ansatz für das Risikomanagement verfolgt, während die FMEA eher ein Zuverlässigkeitsinstrument ist. Hersteller von Medizinprodukten müssen jedoch die ISO 14971 einhalten, um die Erwartungen der Aufsichtsbehörden in Bezug auf Risikomanagementstandards zu erfüllen.
Wenn Sie mehr über die Einhaltung der Norm ISO 14971:2016 und Beratungsdienstleistungen zum Risikomanagement erfahren möchten, wenden Sie sich noch heute an Freyr!









