Ein „Prädikatprodukt“ ist ein Medizinprodukt, das zuvor von der US and Drug Administration (US FDA) zugelassen wurde und bereits auf dem Markt ist. Es dient als Referenzpunkt für neue Medizinprodukte, die über das510(k)-Zulassungsverfahren FDAzugelassen werden sollen.
Das zu prüfende Produkt muss nachweislich mindestens so sicher und wirksam sein wie das Prädikatsprodukt in Bezug auf seine Zweckbestimmung und technischen Merkmale. Dieser Vergleich wird als Feststellung der "wesentlichen Gleichwertigkeit" bezeichnet.
Ein neues Produkt muss nicht mit dem Prädikatsprodukt identisch sein, damit es dem Prädikatsprodukt im Wesentlichen gleichwertig ist.
Wie identifiziert man ein Prädikatgerät?
Die Datenbank FDAenthält einen dreistelligen Produktcode für jede Geräteklassifizierung. Die FDA (k)-Datenbank enthält Informationen zu allen Geräten, die im Rahmen des510(k)-Verfahrens zugelassen wurden. Sobald Sie den dreistelligen Produktcode haben, können Sie eine Liste aller Produkte, aller Unternehmen und der Handelsnamen aller Wettbewerber oder potenziellen Wettbewerber abrufen, die Sie sich ansehen möchten. Anschließend können Sie eine eingehende Analyse und einen Vergleich durchführen, um ein Referenzprodukt einzugrenzen.
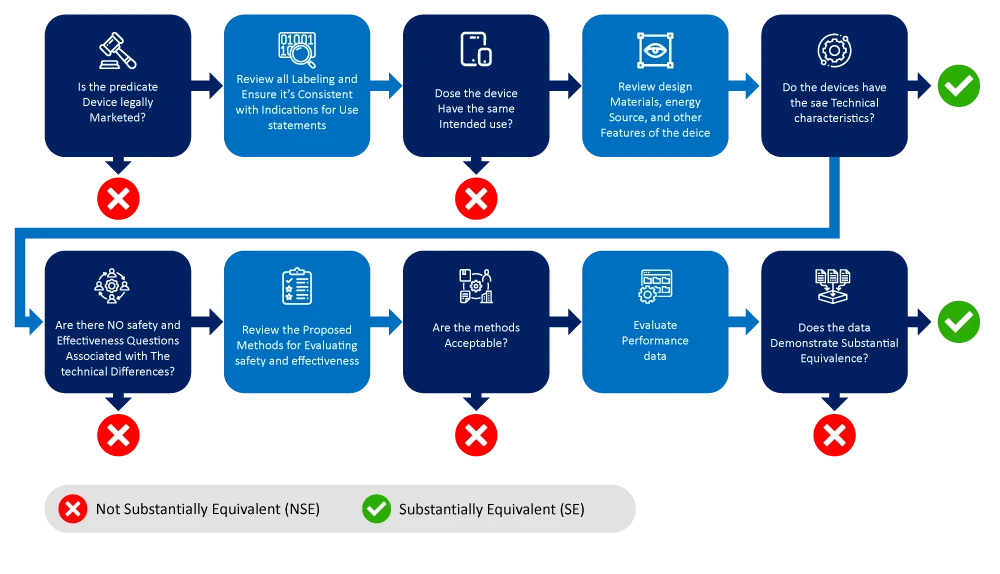
Nachstehend finden Sie ein Flussdiagramm, das den Prozess der Identifizierung und Eingrenzung eines Referenzprodukts veranschaulicht.
Faktoren, die bei der Bestimmung des/der Prädikatsgeräte(s) zu berücksichtigen sind
- Bestimmungsgemäße Verwendung: Die Zweckbestimmung des Vorgängerprodukts sollte mit der des neuen Produkts vergleichbar sein. Wenn das neue Produkt beispielsweise für die Herzüberwachung bestimmt ist, sollte auch das Prädikatsprodukt ein Herzüberwachungsgerät sein.
- Technologische Merkmale: Das Vorgängergerät sollte mit dem neuen Gerät in Bezug auf die technischen Merkmale identisch sein. So sollten z. B. die Konstruktion, die verwendeten Materialien und die Funktionsweise ähnlich sein.
- Biokompatibilität: Die Bewertung der Biokompatibilität eines Medizinprodukts oder einer Komponente sollte sich nicht nur auf die für das Produkt und den Herstellungsprozess verwendeten Rohstoffe beschränken, sondern es sollten auch zusätzliche Chemikalien berücksichtigt werden. Dieser Faktor gilt jedoch nicht für IVDs.
- Neueste Technologie: Das Prädikatsprodukt sollte nicht veraltet sein und dem neuesten Stand der Medizintechnik entsprechen.
Das Prädikatsprodukt ist ein Schlüsselfaktor bei der Entscheidung, ob ein neues Medizinprodukt über den 510(k)-Pfad auf den Markt gebracht werden kann. Die Wahl des falschen Prädikats kann ein teureres und zeitaufwändigeres Zulassungsverfahren zur Folge haben, während die Wahl des richtigen Prädikats dazu beitragen kann, die Kosten und den Zeitaufwand für die Markteinführung eines neuen Medizinprodukts zu verringern. Wenn das Prädikatsprodukt nicht geeignet ist, kann dies zu Verzögerungen und zusätzlichen Kosten führen.
Wenn Sie Unterstützung beim 510(k)-Einreichungsprozess für Ihr Medizinprodukt benötigen, vereinbaren Sie einen Termin für ein Telefonat mit den Experten Freyr , die Ihnen bei der Abwicklung der Verfahren behilflich sein können. Bleiben Sie auf dem Laufenden. Bleiben Sie konform.









