Im Laufe der Jahre hat sich mit den Fortschritten der Software und der Digitalisierung die Art und Weise, wie medizinische Geräte verwaltet und bereitgestellt werden, grundlegend verändert. Die Integration von Software in medizinische Geräte hat rapide zugenommen und führt zu unglaublichen Fortschritten bei der Bereitstellung von Gesundheitslösungen in verschiedenen Bereichen wie Diagnose, Krankheitsprävention und Behandlung von Verletzungen oder Krankheiten.
Die Auswirkungen von Software auf die Sicherheit und Leistung von Medizinprodukten sind jedoch umstritten, insbesondere wenn es sich bei dem Produkt selbst um ein reines Softwareprodukt handelt. Daher werden die Vorschriften für Medizinproduktesoftware ständig überarbeitet, um die Einstufung von software as a medical device SaMD) zu regeln. Vor kurzem hat sich der Beirat der European Commission die Medical Device Coordination Group (MDCG) European Commission auf die Verbesserung der Vorschriften für Medizinproduktesoftware konzentriert und einen Leitfaden veröffentlicht, in dem der anzuwendende Ansatz beschrieben wird, um zu bestimmen, ob eine Software ein Medizinprodukt ist oder nicht. Was beinhaltet dieser Leitfaden? Lassen us .
Der Geltungsbereich des Leitfadens
Der Leitfaden der MDCG umfasst sowohl Software für Medizinprodukte als auch Software für In-vitro-Diagnostika (IVD). Gemäß dem Dokument ist eine Medizinproduktesoftware (MDSW) definiert als eine Software, die allein oder in Kombination für einen Zweck verwendet werden soll, der in der Definition eines "Medizinprodukts" in der Medizinprodukteverordnung 2017/745 (MDR) oder der Verordnung über In-vitro-Diagnostika 2017/746 (IVDR) festgelegt ist. Sie beschreibt die Kriterien, die anzuwenden sind, um festzustellen, ob eine zu prüfende Software ein Medizinprodukt ist oder nicht, und soll Herstellern von Medizinprodukten und anderen Parteien zusätzliche Klarstellungen und Empfehlungen zu MDSW geben.
Zunächst werden in dem Leitfaden die wichtigsten Begriffe erläutert, die im Zusammenhang mit der MDSW verwendet werden, darunter:
Zweckbestimmung: Die Verwendung, für die ein Produkt gemäß den Angaben des Herstellers auf dem Etikett, in der Gebrauchsanweisung oder in Werbe- oder Verkaufsunterlagen oder -erklärungen bestimmt ist und die vom Hersteller in der klinischen Bewertung angegeben wurde.
Zubehörteil: Ein Gegenstand, der zwar selbst kein Medizinprodukt ist, der aber von seinem Hersteller dazu bestimmt ist, zusammen mit einem oder mehreren Medizinprodukten verwendet zu werden, um speziell die Anwendung des/der Medizinprodukte(s) gemäß seiner/ihrer Zweckbestimmung zu ermöglichen oder um die Funktionalität des/der Medizinprodukte(s) speziell und direkt im Hinblick auf seine/ihre Zweckbestimmung zu unterstützen. Darüber hinaus erwähnt die MDCG, dass das Software-Zubehör die Verwendung eines Medizinprodukts steuern oder beeinflussen kann und dass die Gebrauchsanweisung und andere vom Hersteller bereitgestellte Unterlagen Einzelheiten darüber enthalten sollten, wie die geeignete Software und das Zubehör ausgewählt werden sollten.
Software: Sie steht für eine Reihe von Anweisungen, die Eingabedaten verarbeiten und Ausgabedaten erzeugen.
Bestimmung der Software für medizinische Geräte
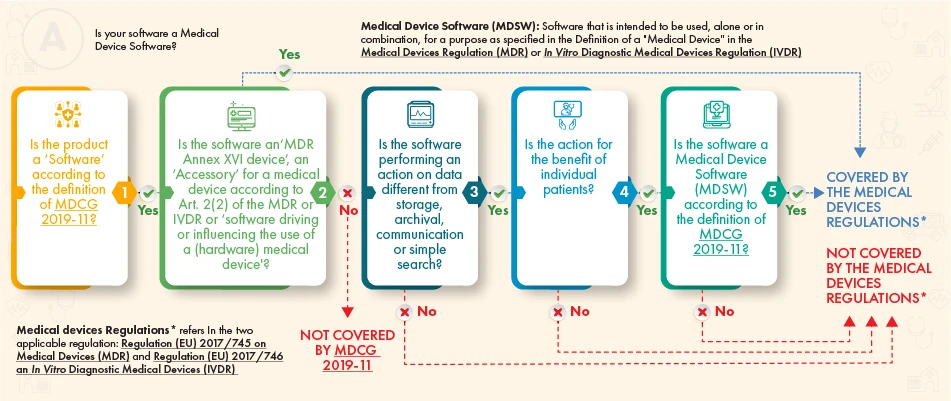
Gemäß dem obigen Flussdiagramm sollte die betreffende Software der Regulierung unterliegen, wenn sie die folgenden Kriterien erfüllt:
- die Definition eines Medizinprodukts, eines Zubehörs dazu oder die Funktionsweise des Medizinprodukts, oder
- Sie führt eine zusätzliche Verarbeitung von Daten durch (nicht nur Speicherung oder Kommunikation) und ihre Wirkung schafft einen Nutzen für die Patienten und entspricht der Definition von Medizinproduktesoftware gemäß den Leitlinien der MDCG
In-vitro-Diagnostika Software-Bestimmung
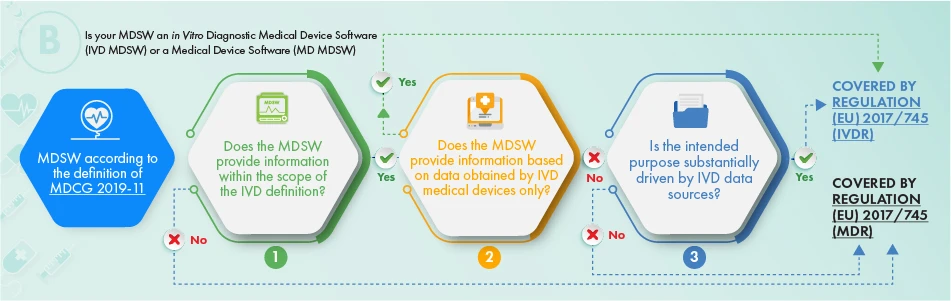
Das obige Flussdiagramm beschreibt die Vorgehensweise bei Produkten, die für In-vitro-Diagnosezwecke bestimmt sind. Um festzustellen, ob die betreffende Software einer Regulierung unterworfen werden sollte, sind die folgenden Kriterien zu berücksichtigen:
- die Definition eines Medizinprodukts, eines Zubehörs dazu oder die Funktionsweise des Medizinprodukts, oder
- Es liefert die Informationen, die üblicherweise von In-vitro-Diagnostika geliefert werden, und nur die Informationen, die von einem In-vitro-Diagnostikum gesammelt werden, oder
- Der Verwendungszweck der Software bezieht sich auf IVDR-Angelegenheiten
Gemäß der MDCG-Leitlinie hat die Art der Verbindung zwischen der Software eines Medizinprodukts und dem Produkt keinen Einfluss auf die Einstufung der Software als Produkt gemäß der MDR und IVDR. Die Software eines Medizinprodukts kann entweder als eigenständiges Produkt existieren oder in ein Hardware-Gerät integriert sein und klärt die folgenden regulatorischen Anforderungen:
- In Anbetracht seiner Qualifikation und Klassifizierung muss ein eigenständiges Softwareprodukt für Medizinprodukte in vollem Umfang den Regulierungsverfahren gemäß den geltenden Rechtsvorschriften unterzogen werden.
- Eine Software für ein Medizinprodukt, die integraler Bestandteil oder Teil eines Hardware-Medizinprodukts ist, könnte im Rahmen des vereinfachten Verfahrens in Verkehr gebracht werden. Sie würde nicht gesondert, sondern im Rahmen der allgemeinen Bewertung des Hardware-Medizinprodukts selbst geprüft werden.
Zusammenfassend lässt sich sagen, dass die MDCG-Leitlinien die wesentlichen Aspekte im Zusammenhang mit der Klassifizierung von Medizinprodukt-Software und der Festlegung der anzuwendenden regulatorischen Anforderungen abdecken. Medizinproduktehersteller, Softwareentwickler und andere Parteien müssen die MDCG-Empfehlungen befolgen und umsetzen, um die Konformität sicherzustellen. Um weitere Informationen zur Einstufung Ihrer software as a medical device zu erhalten, wenden Sie sich an einen Experten für regulatorische Fragen. Bleiben Sie auf dem Laufenden. Bleiben Sie konform.









