Die Kennzeichnung ist ein wesentlicher Bestandteil der Vermarktung von Medizinprodukten. Das Etikett ist eine Information, die in einem für Menschen lesbaren Format auf dem Produkt und/oder der Verpackung angebracht ist. Der Hauptzweck der Kennzeichnung besteht darin, Sicherheitsinformationen für Benutzer bereitzustellen, bei denen es sich um medizinisches Fachpersonal, Verbraucher oder andere relevante Personen handeln kann.
Alle weltweiten Aufsichtsbehörden haben bestimmte Kennzeichnungsvorschriften. Ebenso hat die EU die Kennzeichnungsvorschriften in Kapitel III unter Anhang I der EU-Medizinprodukteverordnung (EU MDR) 2017/745 detailliert festgelegt. Das Wichtigste dabei ist, dass alle Symbole, die die erforderlichen Informationen abdecken, in der Kennzeichnung des Produkts und den dazugehörigen Dokumenten (Broschüren, Handbücher, Gebrauchsanweisungen usw.) enthalten sind.
Einige der wichtigsten Überlegungen zur Kennzeichnung, die bei der Einhaltung der EU MDR zu beachten sind, sind:
1. Symbolik der Kennzeichnung von Medizinprodukten
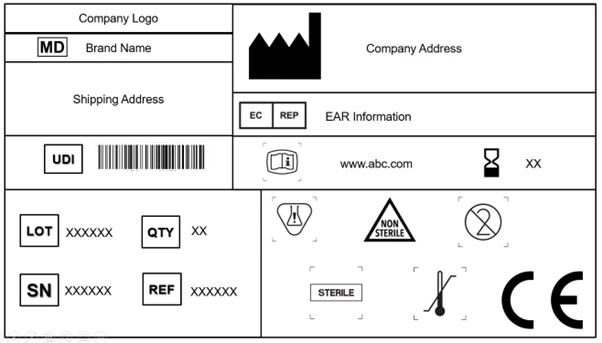
Jeder Hersteller ist verpflichtet, das Symbol für Medizinprodukte anzubringen, das besagt, dass es sich bei dem auf dem EU-Markt angebotenen Produkt um ein Medizinprodukt handelt. Dieses Symbol muss auf dem Produkt und auf allen Ebenen der Verpackung angebracht werden. Außerdem müssen auf dem Etikett der Handelsname und die ursprüngliche Bezeichnung des Produkts angegeben werden.
2. Besondere Geräte
Handelt es sich bei dem Produkt um ein Spezialprodukt oder eine Sonderanfertigung, sollte der Status auf dem Etikett angegeben werden. Wenn das Produkt z. B. nur für klinische Prüfungen bestimmt ist, sollte dies auf dem Etikett ausdrücklich erwähnt werden.
Bei Produkten, die absorbierende Materialien enthalten oder die sich lokal im menschlichen Körper verteilen können, sollte die Kennzeichnung die Zusammensetzung des Materials und quantitative Angaben zu den wichtigsten Bestandteilen enthalten.
Bei Einwegprodukten und sterilen Produkten ist sogar eine ausdrückliche Kennzeichnung erforderlich. Bei den wiederaufbereiteten Produkten sollte die Kennzeichnung die Anzahl der Aufbereitungen, die Anzahl der bisherigen Aufbereitungen und das verwendete Sterilisationsverfahren enthalten.
3. Vorhandensein von toxischen Stoffen
Die Deklaration des Vorhandenseins von CMR-Stoffen (krebserzeugend, erbgutverändernd, fortpflanzungsgefährdend) und von Stoffen mit endokriner Wirkung ist auf den Etiketten obligatorisch, wenn die Konzentration mehr als 0,1 % w/w beträgt. Die Liste dieser Stoffe muss auf dem Produkt und/oder der Verpackung angebracht werden.
Außerdem müssen die Produkte mit einem Hinweis auf das Vorhandensein von Blut- und Gewebederivaten versehen werden (auch wenn diese im Arzneimittel des Kombinationsprodukts enthalten sind).
4. Harmonisierte Normen
Die EU MDR erkennt die Norm ISO 15223-1: 2021 an und akzeptiert sie. Das Dokument legt die Symbole fest, die bei der Kennzeichnung von Medizinprodukten und deren Verpackungen zu verwenden sind. In Kapitel 3 (23.1,h) des Anhangs I der EU MDR , dass international anerkannte Symbole verwendet werden können und dass in Regionen, in denen diese Symbole nicht anerkannt sind, eine Beschreibung derselben in einem Dokument zusammen mit dem Produkt bereitgestellt werden muss.
5. UDI
In den Artikeln 27, 28, 29 und Anhang VI (A, B, C) sind die Regeln und Vorschriften für die UDI im Einzelnen aufgeführt. Das Etikett muss nun einen UDI-Träger [AIDC (Automated Identification for Data Capture) und HRI (Human-Readable Interpretation) Darstellung der UDI] auf dem Produkt und auch auf höheren Verpackungsebenen enthalten. Die höheren Verpackungsebenen des Produkts (mit Ausnahme der Versandverpackungen) werden ihren eigenen UDI-Träger haben.
6. Elektronische Informationen zur Nutzung (eIFU)
Webadressen (URL) in Form von eIFUs können zusammen mit den Papier-IFUs auf der Kennzeichnung von Medizinprodukten angebracht werden. Die eIFUs können bei implantierbaren, aktiven implantierbaren, fest installierten Medizinprodukten und Software (auch für Laien) verwendet werden.
7. Information der Wirtschaftsbeteiligten (EOs)
Das Etikett enthält in der Regel die Angaben des Herstellers. Bei ausländischen Herstellern sollten jedoch die Angaben des Bevollmächtigten auf den Handelsetiketten angebracht werden.
8. Warnungen und Vorsichtsmaßnahmen
Die Warnhinweise und Vorsichtsmaßnahmen müssen auf dem Etikett des Geräts angegeben werden. Die Informationen zu diesem Aspekt können auf ein Minimum beschränkt werden, und Einzelheiten dazu können in der Gebrauchsanweisung angegeben werden.
Die Hersteller müssen sich auch an die länderspezifischen Kennzeichnungsvorschriften gewöhnen. Die sprachlichen Anforderungen hängen vom jeweiligen EU-Mitgliedstaat ab. Sie kann die Kennzeichnung, die Gebrauchsanweisung und die Verpackung des Geräts in Bezug auf Zeit und Kosten stark beeinflussen.
Diese zusätzlichen Anforderungen können die Belastung des Herstellers durch die Komplexität des bestehenden Kennzeichnungsprozesses noch erhöhen. Ein Versagen in diesem Bereich kann sehr kostspielig werden und Produktrückrufe und anschließende Schritte für Korrektur- und Vorbeugungsmaßnahmen (CAPA) nach sich ziehen.
Benötigen Sie Unterstützung bei der Kennzeichnung gemäß der EU MDR? Freyr umfassende Dienstleistungen im Bereich der Kennzeichnung von Medizinprodukten. Wenden Sie sich gerne an unsere Experten für regulatorische Fragen unter sales@freyrsolutions.com.










