
Die Medizinprodukteverordnung (MDR) der Europäischen Union (EU) sorgt schon seit einiger Zeit für Schlagzeilen. Die MDR hat die Medizinprodukte-Richtlinie (MDD) und die Richtlinie über aktive implantierbare medizinische Geräte (AIMDD) ersetzt. Ursprünglich sollte die gesamte Umstellung bis Mai 2020 vollständig abgeschlossen sein, doch aufgrund der COVID-19-Pandemie wurde die Umsetzung auf den 26. Mai 2021 verschoben. Nach diesem Zeitplan werden bis zum 26. Mai 2024 alle MDD-Zertifikate ungültig, und die Hersteller von Medizinprodukten müssen die EU MDR einhalten. Darüber hinaus dürfen Medizinprodukte, die vor dem 26. Mai 2020 gemäß den Richtlinien 90/385/EWG und 93/42/EWG rechtmäßig in Verkehr gebracht wurden, sowie Medizinprodukte, die ab dem 26. Mai 2020 aufgrund eines Zertifikats in Verkehr gebracht wurden, bis zum 27. Mai 2025 weiterhin auf dem Markt angeboten werden. Die Fristen sind nachstehend dargestellt –
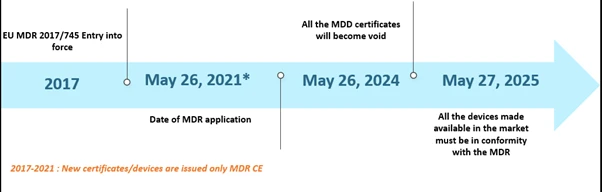
Die Zeitachsen der EU MDR Szenarien der EU MDR
Die begrenzten Kapazitäten der benannten Stellen (NBs) und die mangelnde Vorbereitung der Hersteller stellten jedocheinige Herausforderungen bei der Umsetzung der MDR innerhalb des vorgegebenen Zeitplans dar. Im Oktober 2022 gab es insgesamt achtunddreißig (38) benannte Stellen (NBs), die etwa 8120 Anträge auf EU MDR erhielten, von denen 1990 Zertifikate ausgestellt wurden. Nach ihren Schätzungen hätte mit dem ursprünglichen Zeitplan nur 7000 Zertifikate bearbeitet werden können, was zu einer weiteren Verlängerung des Zeitplans führte. Ein weiterer möglicher Grund für die Verlängerung war die Sicherstellung der weiteren Verfügbarkeit sicherer Medizinprodukte, deren Zertifikate bereits abgelaufen sind oder vor dem 26. Mai 2024 ablaufen werden. Das aktuelle Szenario für den verlängerten Zeitplan ist unten dargestellt.
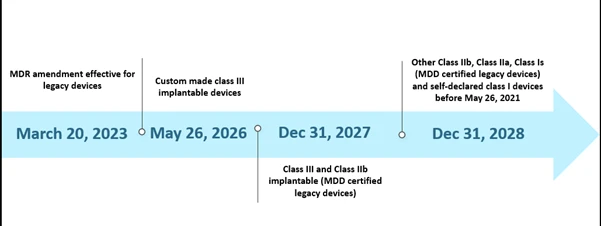
Die Zeitachsen der EU MDR Szenarien der EU MDR
Die neue Verlängerung gilt für Altprodukte, die Artikel 120 (3e) erfüllen und am 20. März 2023 eine gültige CE-Kennzeichnung der MDD oder eine Ausnahmeregelung besitzen, und wird zusammen mit den CE-gekennzeichneten Produkten der MDR auf dem Markt bleiben. Bis zum 26. Mai 2024 sollten die Hersteller von Altprodukten über ein implementiertes QMS verfügen und bei einer von der MDR benannten BS einen Antrag auf Konformitätsbewertung gestellt haben, und bis zum 26. September 2024 sollten die Hersteller von Altprodukten eine Vereinbarung mit einer von der MDR benannten BS geschlossen haben.
Schauen wir uns nun an, welche Auswirkungen diese Erweiterung auf die Hersteller haben könnte.
Möglichkeiten, die die Hersteller mit dieser Erweiterung haben:
- Erweiterter Marktzugang für MDD/AIMDD-zertifizierte Gerätehersteller, die bereits Maßnahmen zur Einhaltung der MDR ergriffen haben.
- Die MDR-zertifizierten Hersteller, deren MDD/AIMDD-CE-Zertifikate nicht widerrufen wurden, dürfen bis zum Ende der Übergangsfrist neben ihren MDR-konformen Geräten auch Altgeräte auf den Markt bringen.
- Hersteller, die zum 20. März 2023 über eine nationale Ausnahmeregelung verfügen, können von der Übergangsfrist profitieren.
- Der Verlängerungszeitraum verschafft mehr Zeit für ein besseres Verständnis der Regeln und Vorschriften, was dazu beiträgt, den Prozess zu straffen und die Einhaltung der MDR zu erreichen.
Herausforderungen, die sich für die Hersteller durch diese Erweiterung ergeben könnten:
- Für Hersteller von Altgeräten, die sich nicht an die MDR halten wollten, gibt es keinen Marktvorteil.
- Die Verlängerung der MDR kann dazu führen, dass sich die Zertifizierungsverfahren in die Länge ziehen und die Produkteinführung verzögern, was eine direkte Folge des Rückstands bei den Prüfungen durch die BS ist.
Welche Maßnahmen sollten die Hersteller ergreifen?
- Es ist zwingend erforderlich, dass die Hersteller die MDR-Risikoklasse ihres Medizinprodukts bestimmen, um rechtzeitig den geeigneten Übergangszeitraum gemäß den geänderten MDR-Vorschriften zu ermitteln.
- Um die Einhaltung der MDR-Vorschriften zu gewährleisten, ist es von entscheidender Bedeutung, die von der MDR benannten BS, die über die für die Klassifizierung Ihres Medizinprodukts erforderliche Kompetenz verfügen, zu ermitteln und mit ihnen in Kontakt zu treten.
- Es ist von entscheidender Bedeutung, eine umfassende Lückenbewertung für Ihr nach der MDD/AIMDD zertifiziertes Medizinprodukt durchzuführen, etwaige Abweichungen von den MDR-Vorschriften zu ermitteln und zu beheben und die rechtzeitige Einhaltung der Vorschriften sicherzustellen.
Für Hersteller ist es unerlässlich, unverzüglich Maßnahmen zu ergreifen, um die Einhaltung der MDR sicherzustellen. Die verlängerte Frist bietet Herstellern zwar einige Möglichkeiten, die MDR-Konformität zu erreichen, bringt aber auch Herausforderungen mit sich, wie z. B. verzögerte Zertifizierungsprozesse und die Kosten für die Einhaltung der Vorschriften. Um diese Herausforderungen zu meistern und die Chancen zu nutzen, lassen Sie sich von unserem Team von Fachleuten durch den MDR-Konformitätsprozess begleiten und sichern Sie sich Ihren Erfolg in diesem anspruchsvollen regulatorischen Umfeld. Vereinbaren Sie us einen Termin mit us , um mehr darüber zu erfahren, wie wir Ihnen helfen können, die MDR-Konformität zu erreichen und der Konkurrenz einen Schritt voraus zu sein. Bleiben Sie informiert. Bleiben Sie konform.









