
Welche Rolle spielt die Cybersicherheit bei medizinischen Geräten?
Das510(k)-Zulassungsverfahrenist ein Regulierungsweg, der von der US-amerikanischen Food and Drug Administration (US FDA) genutzt wird, um die kommerzielle Verbreitung von Medizinprodukten zu bewerten und zu genehmigen. Das Verfahren soll sicherstellen, dass Medizinprodukte für die Verwendung durch Patienten sicher und wirksam sind. Die US FDA Cybersicherheit als „den Prozess der Verhinderung von unbefugtem Zugriff, unbefugter Änderung, unbefugtem Missbrauch oder unbefugter Verweigerung der Nutzung sowie der unbefugten Verwendung von Informationen, die auf einem Medizinprodukt gespeichert sind, abgerufen oder von diesem an einen externen Empfänger übertragen werden“.
Medizinische Geräte werden zunehmend mit Netzwerken verbunden und sind daher anfällig für Cybersecurity-Bedrohungen wie Hackerangriffe, Datenschutzverletzungen und Malware-Angriffe. Die Berücksichtigung der Cybersicherheit in der Entwurfs- und Entwicklungsphase ist entscheidend, um sicherzustellen, dass medizinische Geräte über angemessene Sicherheitskontrollen verfügen. Bedrohungen und Schwachstellen lassen sich nicht ausschalten, und die Verringerung von Cybersicherheitsrisiken ist eine besondere Herausforderung. Wird die Cybersicherheit nicht ordnungsgemäß aufrechterhalten, kann dies zu einer Beeinträchtigung der Gerätefunktionalität, dem Verlust persönlicher oder medizinischer Daten und der Möglichkeit der Ausbreitung von Sicherheitsbedrohungen auf andere vernetzte Netzwerke oder Geräte führen.
Vorfälle, die durch kompromittierte Cybersicherheit verursacht wurden
Cybersicherheitsvorfälle haben dazu geführt, dass medizinische Geräte und Krankenhausnetzwerke nicht mehr funktionsfähig waren, was zu einer Unterbrechung der Patientenversorgung in Gesundheitseinrichtungen in den US geführt hat. Solche Cyberangriffe und Exploits können aufgrund klinischer Risiken auch zu Schäden für Patienten führen, beispielsweise durch Verzögerungen bei der Diagnose und/oder Behandlung von Patienten.
Nachstehend sind die wichtigsten Vorfälle im Gesundheitswesen aufgeführt, die die Bedeutung der Cybersicherheit für die Patientensicherheit unterstreichen.
- Im Jahr 2017 wurden durch den WannaCry-Ransomware-Angriff Krankenhaussysteme und medizinische Geräte auf der ganzen Welt in Mitleidenschaft gezogen.
- Im Jahr 2020 zeigte ein Ransomware-Angriff auf ein deutsches Krankenhaus die potenziellen 83 Auswirkungen einer verzögerten Patientenversorgung, da die Patienten aufgrund des Angriffs in ein anderes Krankenhaus verlegt werden mussten.
Die wichtigsten Überlegungen zur Cybersicherheit bei der 510(k)-Freigabe
Im Folgenden sind die allgemeinen Grundsätze der Cybersicherheit für Hersteller von Medizinprodukten gemäß denFDA US FDA für Zulassungsanträge vor dem Inverkehrbringen aufgeführt.
- Qualitätssystemverordnung (QSR):Hersteller sollten sich bereits in der Entwurfs- und Entwicklungsphase von Medizinprodukten mit Fragen der Cybersicherheit befassen, da dies zu einer robusteren und effizienteren Minderung von Risiken für Patienten führen kann. Hersteller sollten im Rahmen der gemäß 21 CFR 820.30(g) erforderlichen Softwarevalidierung und Risikoanalyse cybersicherheitsbezogene Designvorgaben für ihre Produkte sowie einen Ansatz zum Umgang mit Cybersicherheitslücken und deren Management festlegen.
- Designsicherheit:Gerätehersteller müssen sicherstellen, dass ihre Produkte unter Berücksichtigung der Gerätesicherheit entwickelt werden. Die US FDA die Angemessenheit der Sicherheit anhand der Fähigkeit des Geräts, Sicherheitsziele wie Authentizität, Autorisierung, Verfügbarkeit, Vertraulichkeit und Sicherheit sowie zeitnahe Aktualisierbarkeit in der gesamten Systemarchitektur zu gewährleisten und umzusetzen.
- Transparenz: Ein Mangel an Cybersicherheitsinformationen über das Produkt, wie z. B. Informationen, die für die Integration des Produkts in die Nutzungsumgebung erforderlich sind, sowie Informationen, die die Nutzer zur Aufrechterhaltung der Cybersicherheit während des Lebenszyklus des Produkts benötigen, kann die Sicherheit und Wirksamkeit des Produkts beeinträchtigen. Um diese Bedenken auszuräumen, ist es wichtig, dass die Produktnutzer Zugang zu den Informationen über Cybersicherheitskontrollen, potenzielle Risiken und andere relevante Informationen haben.
- Einreichungsdokumentation: Es wird erwartet, dass der Entwurf und die Dokumentation der Cybersicherheit eines Produkts mit dem Cybersicherheitsrisiko des Produkts Schritt halten. Die Hersteller sollten das größere System berücksichtigen, in dem ein Produkt verwendet werden kann.
Abbildung 1: Gemeinsame Cybersicherheitsherausforderungen und Lösungen 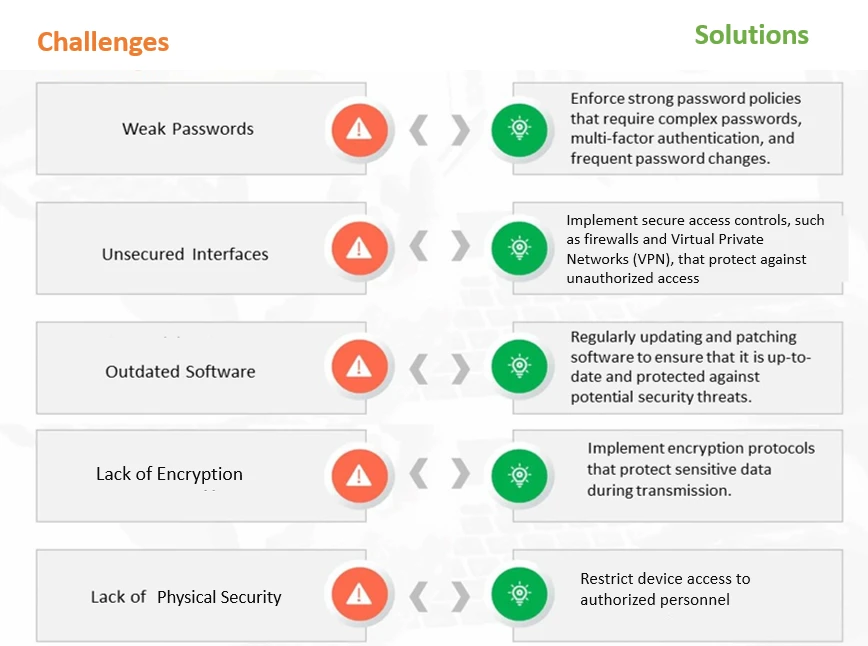
Schlussfolgerung
Zusammenfassend lässt sich sagen, dass Cybersicherheit bei Medizinprodukten von entscheidender Bedeutung ist, um die Patientensicherheit zu gewährleisten und Vorfälle zu verhindern, die die Gesundheitsversorgung beeinträchtigen könnten.FDA US FDA betonen die Notwendigkeit, dass Hersteller Cybersicherheitsprobleme bereits bei der Konzeption und Entwicklung von Medizinprodukten berücksichtigen und transparente Informationen zu Cybersicherheitskontrollen bereitstellen. Die QSR, die Sicherheit des Designs, Transparenz und die Einreichungsunterlagen sind wichtige Faktoren für die 510(k)-Zulassung. Es ist auch wichtig, häufige Cybersicherheitsprobleme wie Schwachstellen in Komponenten von Drittanbietern und Ransomware-Angriffe anzugehen und Lösungen wie robuste Risikoanalysen und regelmäßige Software-Updates zu implementieren.
Setzen Sie sich mit unseren Experten für Zulassungsfragen in Verbindung, um ein problemloses und konformes 510(k)-Zulassungsverfahren zu erhalten . Bleiben Sie informiert! Bleiben Sie gesetzeskonform!









