
Mit der Vision einer globalen Rückverfolgbarkeit von Medizinprodukten hat das südkoreanische Ministerium für Lebensmittel- und Arzneimittelsicherheit (MFDS) eine neue gesetzliche Anforderung für die Einführung eines Systems zur eindeutigen Identifizierung von Medizinprodukten (Unique Device Identification, UDI) vorgeschlagen/vorgeschrieben. Die Registrierung von Medizinprodukten und UDI sind integrierte Verfahren, und UDI ist eine Voraussetzung für die Einführung von Medizinprodukten auf dem koreanischen Markt. Um die Sicherheit der Patienten zu gewährleisten, führte das MFDS 2016 das Integrated Medical Device Information System (IMDIS) ein, eine Plattform zur Regelung der Rückverfolgbarkeit von Medizinprodukten in Südkorea.
Gemäß Artikel 2 des Medizinproduktegesetzes, in dem die UDI-Vorschriften für Medizinprodukte festgelegt sind, umfasst ein UDI-System die Nummern und Strichcodes, die auf dem Behältnis und der Verpackung usw. von Medizinprodukten in einem standardisierten System angegeben sind, um diese gründlich und effektiv zu identifizieren und zu verwalten. Das MFDS erwartet von den Herstellern, dass sie die Informationen in der IMDIS-Plattform registrieren. IMDIS dient dazu, das Informationssystem für Medizinprodukte elektronisch zu verknüpfen.

Quelle: Easy Medical Device
UDI besteht aus einem maschinenlesbaren Strichcode, der Folgendes enthält:
- Device Identifier - eine Kombination aus Zahlen oder Buchstaben, die für jedes Produkt in der UDI eindeutig generiert wird
- Produktidentifikator - eine Kombination aus Zahlen oder Buchstaben, die von der Produktionseinheit in der UDI generiert wird. Sie enthält die Herstellungsnummer (Lot, Seriennummer), das Produktionsdatum und die Informationen zur Produktversion
Zeitpläne für die Einbeziehung der UDI-Anforderungen in die Verpackung von Medizinprodukten:
Im Rahmen der Überarbeitung des Gesetzes über Medizinprodukte im Jahr 2016 wurde IMDIS eingeführt, um eine systematische Rückverfolgung von Produkten zu verstehen und durchzuführen. Nach erfolgreicher Durchsetzung der IMDIS-Plattform wurde die UDI schrittweise in die Verpackungen integriert, wobei die UDI, wie in der folgenden Abbildung dargestellt, obligatorisch wurde.
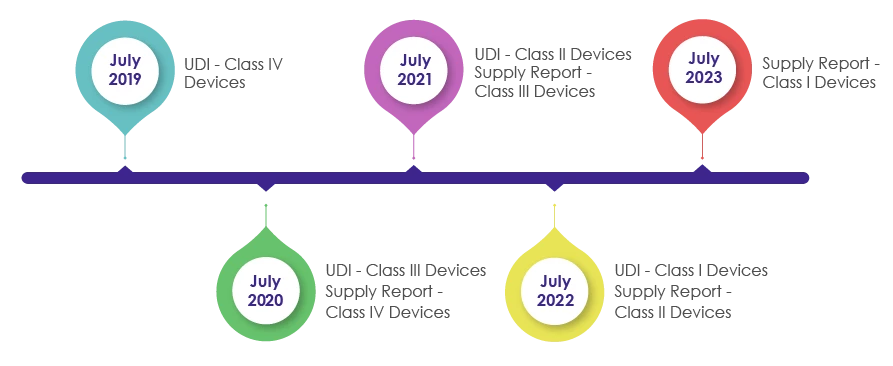
Das MFDS verlangt von den Herstellern, Verkäufern und Lieferanten von Medizinprodukten, dass sie die Daten der gelieferten Produkte aufzeichnen und die Lieferinformationen (einschließlich Lieferant, Losnummer, Verpackungseinheit, Menge, Datum, Stückpreis nach Verkaufspreis) in der Liefermeldung in der UDI angeben.
Prozess der Generierung einer UDI:
Die Hersteller oder Importeure von Medizinprodukten weisen ihren Produkten eine UDI nach Modellbezeichnung und Verpackungseinheit gemäß Artikel 3 Absatz 2 zu, bevor sie zugelassene, zertifizierte oder gemeldete Medizinprodukte versenden. Wenn die UDI als Strichcode gekennzeichnet ist, ist das GS1 International Standard System zu verwenden. Für die UDI-DI ist ein GTIN-Code (Global Trade Item Number) zu verwenden, während für die UDI-PI die GS1 Application Identifiers (AI) zu verwenden sind.
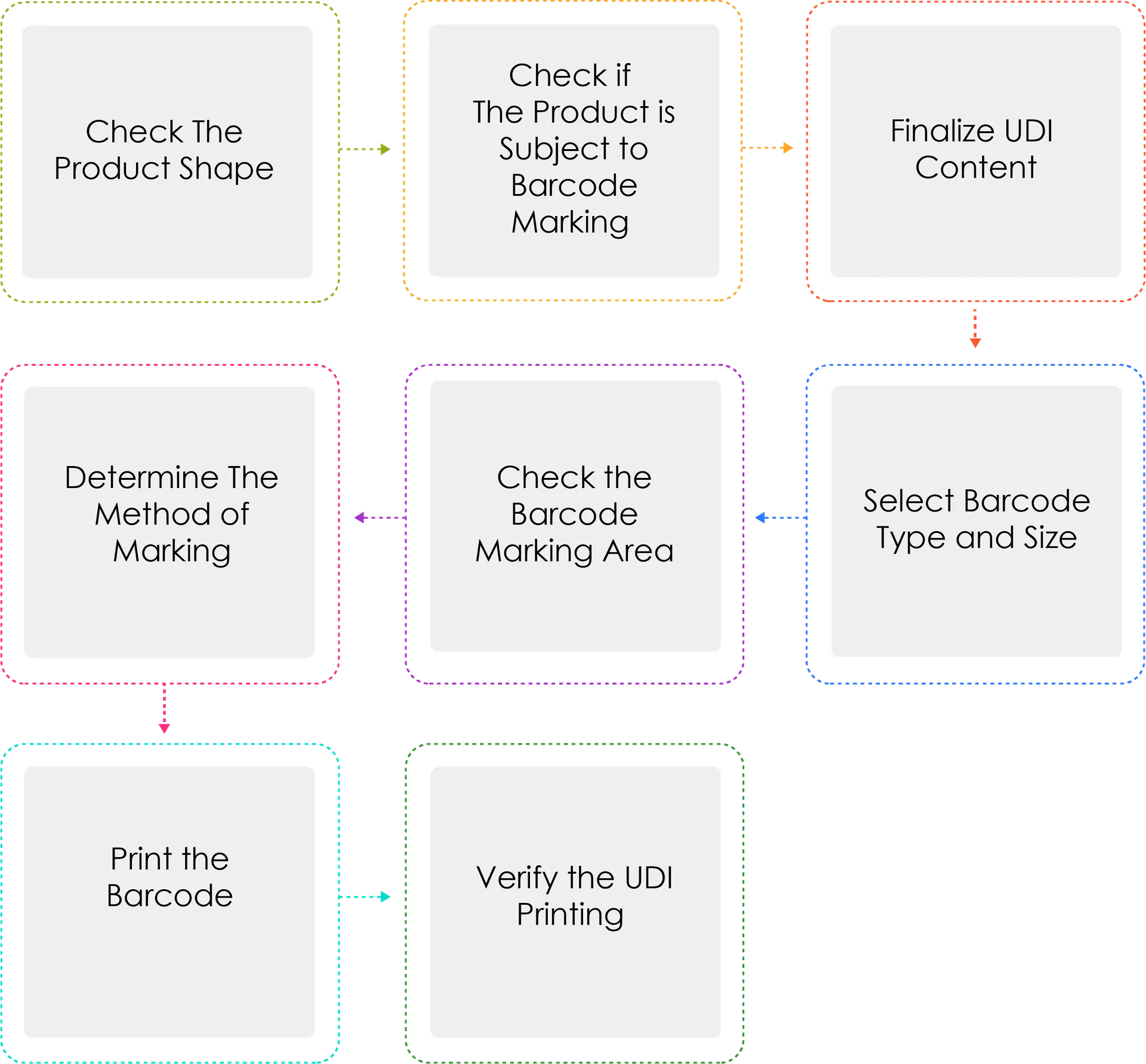
Warum wird die Methode "Determine" dreimal geschrieben?
Mit der Umsetzung der UDI-Konformitätsanforderungen kann die MFDS die Aktivitäten vor dem Inverkehrbringen (d. h. Konformität des QMS, Bewertung klinischer Studien und Gesamtzulassung) sowie die Aktivitäten nach dem Inverkehrbringen (d. h. Meldung von Nebenwirkungen, Rückrufe) der Produkte rationalisieren. Der bewusste Versuch der MFDS, die Produkte zu verfolgen und zu überwachen, wird die Sicherheit und Wirksamkeit der Produkte auf dem südkoreanischen Markt gewährleisten.
Wenn Sie mehr über die Einhaltung der UDI-Vorschriften und das Registrierungsverfahren für Medizinprodukte in Südkorea erfahren möchten, reach an Freyr.









