
Die Medizinprodukte werden einer Konformitätsbewertung unterzogen, bevor sie in die ARTG-Liste aufgenommen werden, um sicherzustellen, dass sie den grundlegenden Anforderungen der australischen Arzneimittelbehörde (Therapeutic Goods Administration, TGA) entsprechen. Die grundlegenden Anforderungen umfassen im Wesentlichen die Sicherheits- und Leistungsmerkmale, die jedes Produkt erfüllen muss, damit es in Australien verkauft werden darf. Ähnlich wie in der EU basiert die Konformitätsbewertung in Australien auf der Risikoklasse des Produkts. Daher hängt der für ein Produkt zu durchlaufende Konformitätsbewertungsprozess von seiner Klassifizierung ab.
Es gibt verschiedene regulatorische Standards, die für verschiedene Arten von Geräten gelten. Die Einhaltung eines oder mehrerer dieser Standards ist eine wesentliche Voraussetzung. Die Identifizierung der für das Gerät geltenden relevanten Standards und die anschließende Prüfung des Geräts zum Nachweis seiner Konformität mit dem Standard sind eine Grundvoraussetzung.
Die Konformitätsbewertung umfasst eine systematische Prüfung der technischen Unterlagen zum Produkt. Die Risikomanagement-, klinischen Bewertungs-, Herstellungsprozess- und Überwachungsaktivitäten des Herstellers sind die entscheidenden Bereiche für die Bewertung. Produkte, für die ein TGA-Konformitätsbewertungszertifikat erforderlich ist, sind in Vorschrift 4.1 der Therapeutic Goods (Medical Devices) Regulations 2002 aufgeführt. Während ein von der TGA ausgestelltes Konformitätsbewertungszertifikat eine Voraussetzung für die Vermarktung der meisten Medizinprodukte in Australien ist, akzeptiert die TGA auch Konformitätsbewertungszertifikate, die von benannten Stellen in Europa ausgestellt wurden. Darüber hinaus akzeptiert die TGA auch Konformitätsbewertungen aus Ländern, die Teil des MDSAP Medical Device Single Audit Program) sind.
Die Anforderungen an die Konformitätsbewertung variieren je nach Risikokategorie des Produkts. Tabelle Nr. 1 enthält Einzelheiten zum klassifizierungsbasierten Konformitätsbewertungsverfahren in Australien.
Konformitätsbewertungsverfahren – Australien
Klasse | Konformitätsbewertungsverfahren | Verantwortlichkeiten des Herstellers |
| I | Teil 6 (Konformitätserklärung, die keiner Bewertung durch den Sekretär bedarf) | Dokumentation zum Nachweis der Konformität mit den wesentlichen Grundsätzen |
| I (messend) & IIa (nicht steril) | Teil 6 (Konformitätserklärung, keine Bewertung durch den Sekretär erforderlich) Teil 5 (Produktqualitätsmanagementsystem) | Dokumentation zum Nachweis der Konformität mit den wesentlichen Grundsätzen. Implementierung eines Produktqualitätsmanagementsystems für die Endkontrolle und Prüfung für Audits. Hinweis: Die Vorlage einer Konformitätserklärung ist für Klasse I (nicht messend und nicht steril) nicht erforderlich, sollte jedoch auf Anfrage der TGA vorliegen. |
| I (steril) & IIa (steril) | Teil 6 (Konformitätserklärung, keine Bewertung durch den Sekretär erforderlich) Teil 4 (Qualitätssicherung der Produktion) | Dokumentation zum Nachweis der Konformität mit den wesentlichen Grundsätzen. Implementierung eines Qualitätsmanagementsystems, das Designelemente ausschließt, basierend auf ISO 13485. |
| IIb | Teil 1 (Vollständige Qualitätssicherung) mit Ausnahme von Abschnitt 1.6 (Prüfung der Konstruktion) | Implementierung eines umfassenden Qualitätsmanagementsystems einschließlich Design, Produktion, Kennzeichnung, Verpackung und Endkontrolle auf der Grundlage von ISO 13485. Ausgenommen sind Designunterlagen. |
| III & AIMD | Teil 1 (Vollständige Qualitätssicherung) einschließlich Abschnitt 1.6 (Prüfung der Konstruktion) | Implementierung eines umfassenden Qualitätsmanagementsystems einschließlich Design, Produktion, Kennzeichnung, Verpackung und Endkontrolle auf der Grundlage von ISO 13485. Entwurfsdossier gemäß den wesentlichen Grundsätzen. |
| Systeme oder Verfahrenspakete Teil 7 | (Verfahren für Medizinprodukte, die für einen besonderen Zweck verwendet werden) | Grundlegende Prinzipien. Konformitätsbewertungsverfahren. Klinischer Nachweis für einzelne Komponenten im System oder Paket. |
Tabelle Nr. 1: Konformitätsbewertungsanforderungen für die Geräte
Das übliche Zulassungsverfahren für Medizinprodukte durch die TGA sieht wie folgt aus:
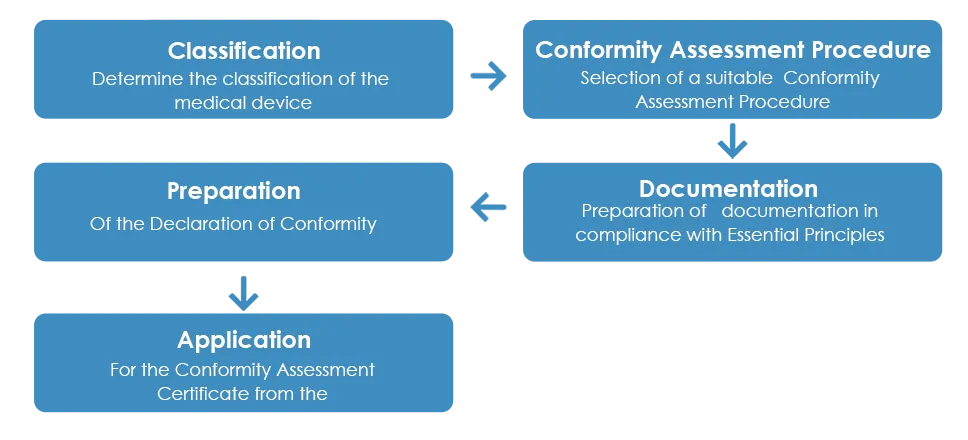
Wie oben beschrieben, muss nach Erhalt des Konformitätsbewertungszertifikats von der TGA eine Konformitätserklärung (DoC) vom Hersteller erstellt werden, in der erklärt wird, dass das Medizinprodukt den geltenden grundlegenden Prinzipien, Klassifizierungsregeln und dem Konformitätsbewertungsverfahren entspricht. Im Gegensatz zum Konformitätsbewertungszertifikat wird eine europäische DoC jedoch von der TGA nicht akzeptiert.
Der australische Markt bietet vielversprechende Perspektiven für Hersteller von Medizinprodukten, sofern die regulatorischen Anforderungen der Therapeutic Goods Administration (TGA) erfüllt werden. Die Konformitätsanforderungen und das Bewertungsverfahren variieren je nach Risikoklasse des Produkts und der In-vitro-Diagnostika. Obwohl die Vorschriften für Medizinprodukte klar definiert und transparent sind, ist ihre Umsetzung komplex, sodass Hersteller möglicherweise Unterstützung von Regulierungspartnern benötigen, um eine erfolgreiche Zulassung ihres Produkts zu erreichen.
Um umfassende Einblicke in die Anforderungen der Konformitätsbewertung, den australischen Sponsor und die ARTG-Listung in Australien zu erhalten,wenden Sie sich an einen bewährten Regulierungsexperten. Bleiben Sie informiert. Bleiben Sie konform.









