
Eine 510(k)- oder Premarket-Notification ist eine Einreichung bei der US-amerikanischen Food and Drug Administration (US FDA), um nachzuweisen, dass das zu vermarktende Produkt sicher und wirksam ist, d. h. im Wesentlichen einem legal vermarkteten oder einem Referenzprodukt entspricht. Im Folgenden sind die drei (03) Arten von 510(k) aufgeführt, die ein Hersteller von Medizinprodukten einreichen kann:
- Traditionell
- Abgekürzt
- Besondere 510(k)
In diesem Blog werden wir die Fälle untersuchen, in denen Ihre Anwendung gemäß denFDA US FDA für die zweite Art, eine verkürzte 510(k), in Frage kommt.
Ein verkürztes 510(k) wird verwendet, um die wesentliche Gleichwertigkeit mit einer anerkannten Norm, einer speziellen Kontrolle oder einer Leitlinie unter Verwendung einer Konformitätserklärung (DoC) nachzuweisen. In einem verkürzten Antrag weisen Hersteller die wesentliche Gleichwertigkeit mit anerkannten Normen auf der Grundlage der Verwendung von Leitfäden oder DoCs anstelle eines Referenzprodukts nach, um die PrüfungFDA US FDAzu erleichtern. Nachstehend finden Sie das Flussdiagramm zur Bestimmung der wesentlichen Gleichwertigkeit für einen verkürzten 510(k)-Antrag.
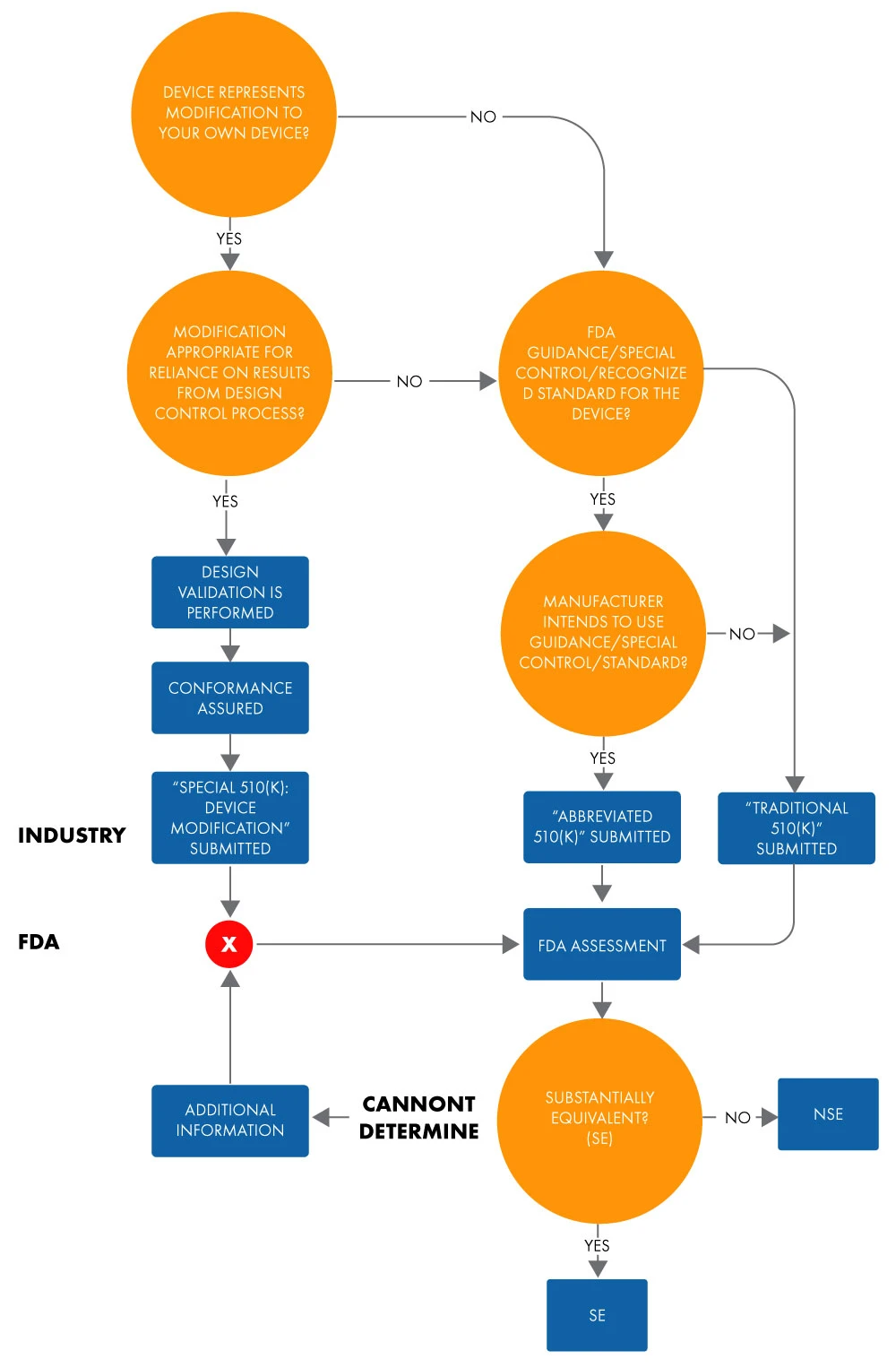
Abbildung 1: Absicht, ein Gerät über 510(k) auf den Markt zu bringen
Der Begriff "abgekürzt" suggeriert, dass diese Art des 510(k)-Zulassungsverfahrens kürzer ist. Dies ist jedoch nicht ganz richtig. Es nimmt genauso viel Zeit in Anspruch wie eine herkömmliche 510(k)-Zulassung. Das Gleiche gilt für die Dokumentation und die Kosten. Außerdem ist das Format der herkömmlichen und der abgekürzten 510(k)-Zulassung in Bezug auf die Gliederung und Struktur ähnlich.
Bei der Einreichung eines abgekürzten 510(k)-Antrags sollten Sie sich auf die in 21 CFR 807.87 genannten Elemente stützen (herkömmliche 510[k]-Anträge). Sie können eine abgekürzte 510(k)-Anmeldung einreichen, wenn die Einreichung auf den folgenden Elementen beruht:
- FDA (e): Beider Einreichung eines verkürzten 510(k)-Antrags sollten Sie einen zusammenfassenden Bericht beifügen, in dem die Einhaltung des relevanten Leitfadens und dessen Verwendung während der Entwicklung und Prüfung des Produkts dargelegt wird.
- Nachweis der Einhaltung besonderer Kontrollen für den Gerätetyp: Siesollten besondere Kontrollen wie Leistungsstandards, Post-Marketing-Überwachung (PMS), Patientenregister, Entwicklung und Verbreitung von Leitlinien, Empfehlungen usw. einhalten, die eine angemessene Gewähr für die Sicherheit und Wirksamkeit des Geräts bieten. Ein verkürzter 510(k)-Antrag, der sich auf eine oder mehrere besondere Kontrollen stützt, sollte Folgendes enthalten. Einen zusammenfassenden Bericht, der die Einhaltung der besonderen Kontrollen und deren Anwendung während der Entwicklung und Prüfung des Produkts beschreibt.
- Wie die Sonderkontrollen eingesetzt wurden, um ein bestimmtes Risiko oder ein Problem anzugehen.
- Informationen über etwaige Abweichungen von den spezifischen Kontrollen und die Bemühungen des Herstellers, diese einzuhalten.
- Freiwillige Konsensnorm(en): Für eine verkürzte 510(k)-Einreichung, die sich auf den anerkannten Standard stützt, müssen Sie eine DoC vorlegen. Eine DoC sollte Folgendes enthalten:
- Name und Anschrift des Antragstellers/Sponsors, der für die Konformitätserklärung verantwortlich ist.
- Einzelheiten zur Produkt-/Geräteidentifikation, einschließlich Produktcodes, Marketingbezeichnung des Geräts, Modellnummer und andere eindeutige Produktidentifikationsdaten, die für die betreffende DoC spezifisch sind.
- Eine Erklärung der Konformität.
- Eine Liste der Normen, für die die Konformitätserklärung gilt, einschließlich der für jede Norm gewählten Option(en), falls vorhanden.
- Die US FDA für jeden Standard.
- Datum und Ort der Ausstellung des DoC.
- Die Unterschrift, der gedruckte Name und die Funktion des für die DoC verantwortlichen Sponsors.
- Jegliche Einschränkung der Gültigkeit der Konformitätserklärung (z. B. wie lange die Erklärung gültig ist, was getestet wurde, Zugeständnisse bezüglich der Testergebnisse usw.)
Zusammenfassend lässt sich sagen, dass eine verkürzte 510(k)-Zulassung eine nützliche Möglichkeit für Produkthersteller ist, die wesentliche Gleichwertigkeit mit anerkannten Standards oder besonderen Kontrollen anhand einer DoC nachzuweisen. Um sich für eine verkürzte 510(k)-Zulassung zu qualifizieren, müssen die Produkthersteller einen zusammenfassenden Bericht vorlegen, in dem sie die Einhaltung der relevanten Leitliniendokumente erklären, die Einhaltung spezieller Kontrollen nachweisen und DoCs zu anerkannten Standards vorlegen. Es ist jedoch wichtig zu beachten, dass das Genehmigungsverfahren, die Dokumentation und die Kosten für eine verkürzte 510(k) mit denen einer herkömmlichen 510(k) vergleichbar sind.
Ist Ihr Medizinprodukt für einen verkürzten 510(k)-Antrag qualifiziert? Wenn Sie Hilfe bei der Einreichung Ihres verkürzten 510(k)-Antrags benötigen, reach an unserenRegulierungsexperten. Bleiben Sie informiert! Bleiben Sie konform!









