Die Konformitätsbewertungsstelle (Conformity Assessment Body, CAB) führt die Konformitätsbewertung verschiedener Beteiligter des Lieferkettensystems für Medizinprodukte durch. Die Konformitätsbewertungsstelle (Conformity Assessment Body, CAB), Malaysia, führt umfangreiche Audits durch, bewertet alle von der Medical Device Authority (MDA), Malaysia, festgelegten Elemente und überprüft die Konformität der Produkte mit den einschlägigen Normen.
In diesem Teil der Blogserie erfahren Sie mehr über die Rolle der KBS bei der Registrierung und Zulassung von Produkten in Malaysia. Außerdem erhalten Sie einen Einblick in die Anforderungen der MDA für die KBS-Zertifizierung, die bereits im ersten Teil behandelt wurde.
Die Konformitätsbewertung ist eine systematische und fortlaufende Prüfung von Nachweisen und Verfahren, um die Sicherheit, Leistung, den Nutzen und das Risiko von Medizinprodukten zu gewährleisten. Sie gewährleistet auch die Einhaltung der Grundlegenden Sicherheits- und Leistungsprinzipien (Essential Principles of Safety and Performance, EPSP) und der Anforderungen des Medizinproduktegesetzes von 2012 (Act 737) bei der Herstellung. Die Klassifizierung eines Medizinprodukts bestimmt die durchzuführenden Konformitätsbewertungsverfahren. Die Konformitätsbewertung wird umso strenger, je höher das Risiko des Medizinprodukts ist; daher ist eine Risikobewertung des Medizinprodukts erforderlich.
Die KBS führen verschiedene Arten von Bewertungen durch, je nach den von der Organisation ausgeführten Geschäftsvorgängen und dem Anwendungsbereich. Sie umfassen:
- Bewertung der technischen Dokumentation
- Bewertung von QMS-Systemen hinsichtlich ISO 13485
- Zertifizierung der guten Vertriebspraxis für Medizinprodukte (GDPMD)
- Vollständige Konformitätsbewertung für die Produktregistrierung
- Vereinfachte Überprüfung für die Registrierung von Geräten
Die KBS spielen eine entscheidende Rolle für alle Beteiligten in der Lieferkette, einschließlich der Hersteller von Produkten, Importeure, Händler, Bevollmächtigte und andere.
Die Importeure, Händler und Bevollmächtigten müssen ihre Niederlassungen bei der MDA registrieren lassen, um ihre Tätigkeit ausüben zu können. Die GDPMD-Zertifizierung ist eine wesentliche Voraussetzung, die zusammen mit dem Antrag auf Niederlassungsgenehmigung eingereicht werden muss. Die KBS führt die Konformitätsbewertung der Qualitätssysteme dieser Einrichtungen hinsichtlich der Einhaltung der vom MDA festgelegten GDPMD-Vorschriften durch, bevor sie das Zertifikat ausstellt. Diese Bewertung umfasst die Überprüfung der technischen Unterlagen sowie die Prüfung der Einrichtungen vor Ort.
Die Gerätehersteller sind ebenfalls von den KBS abhängig, um ihre Geräte bei der MDA in Malaysia registrieren zu lassen. Die inländischen Hersteller verlangen, dass ihre Produktionsstätten bei der MDA registriert sind. der KBS.
Neben der Betriebsregistrierung spielen die KBS auch eine Rolle bei der Produktregistrierung bei der MDA. Medizinprodukte mit Zulassungen von Referenzländern werden von der KBS überprüft, während Produkte ohne Zulassungen von Referenzländern von der KBS vollständig bewertet werden müssen.
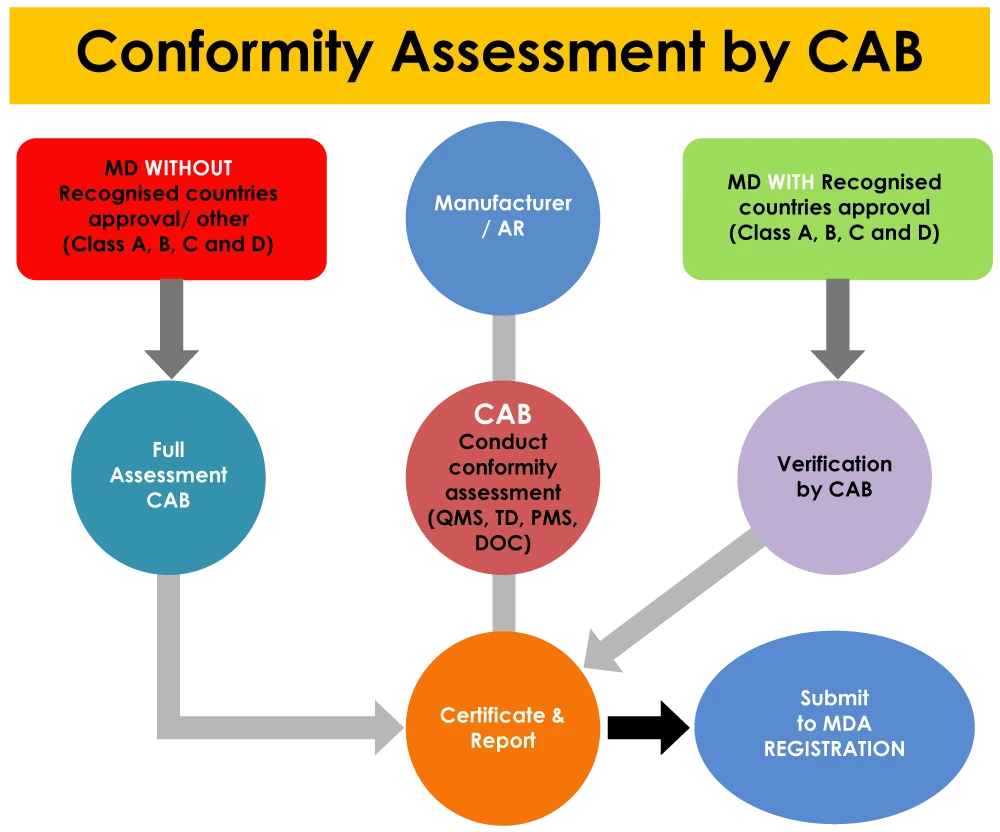
Werden im QMS, im PMS-System und im vollständigen Dossier des Produkts (einschließlich aller Prüfberichte) Mängel festgestellt, besteht eine hohe Wahrscheinlichkeit, dass der Antrag von der KBS abgelehnt wird.
Lesen Sie Teil 1 des Artikels, um die Anforderungen und Genehmigungsverfahren der MDA für die KBS-Zertifizierung kennenzulernen.
Möchten Sie Ihr Medizinprodukt oder IVD auf dem malaysischen Markt einführen? Möchten Sie weitere Einblicke in die Aufgaben und Verantwortlichkeiten der CAB bei der Produktregistrierung erhalten? Reach an einen Experten für regulatorische Fragen. Bleiben Sie informiert. Bleiben Sie konform.









